
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
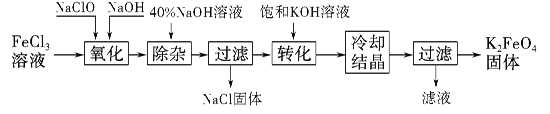
(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为 法。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
【答案】(1)FeCl3+2NaOH+10NaClO = 2Na2FeO4+9NaCl+5H2O
(2)Na2FeO4+2KOH===K2FeO4+2NaOH
(3)重结晶
(4)Fe+8OH--6e-===FeO42-+4H2O
【解析】
试题分析:(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O。
故答案为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
(2)“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH。
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH。
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤。这种分离提纯的方法为重结晶。
故答案为:重结晶 ;
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,阳极电极反应式为Fe+8OH--6e-=FeO42-+4H2O。故答案为:Fe+8OH--6e-=FeO42-+4H2O。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、N的原子序数依次增大,其中X的一种同位素原子没有中子,Y的一种核素可做考古学家测文物的年代,Z为地壳中含量最多的非金属元素,相同质量的W的单质在空气中缓慢氧化的产物与其在空气中燃烧产物不同,但转移的电子数相同,N原子为所在周期中原子半径最小的原子(稀有气体除外)。
(1)写出X元素没有中子的原子符号___________;Y与X形成的X元素的质量分数最高的分子的结构式___________;X、Z、N形成的原子个数比1:1:1的分子的电子式___________。
(2)用电子式表示W2Z形成过程___________;
(3)Z、W、N的简单离子半径从大到小的顺序___________(用离子符号表示);
(4)甲由上述元素X、Y元素形成的18电子分子,常温下是气态,可燃烧。
①甲分子中若两个H原子被Br取代,则可生成___________种溴代物;
②若把甲与氧气设计成燃烧电池(KOH溶液为电解质溶液),则负极反应的方程式为___________;放电一段时间后溶液的碱性___________(增强、减弱、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碘单质的升华过程中不存在化学键破坏的过程
B. NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl-
C. 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D. H2S分子中,所有原子的最外层都达到了8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.伴随着能量变化的物质变化都是化学变化
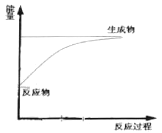
C.下图可表示Ba(OH)2·8H2O与NH4Cl晶体反应的能量变化
D.1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______________;
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______________(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______________H3PO4; HClO4______________HClO3;
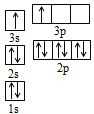
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______________;
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
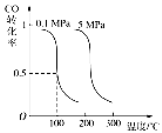
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率
(填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0. 2 mol/ L醋酸溶液,滴定曲线如图所示。
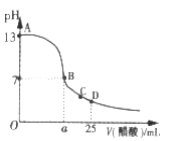
(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。
(3)在D点,溶液中离子浓度大小关系为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com