
【题目】(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______________;
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______________(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______________H3PO4; HClO4______________HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______________;
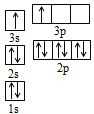
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______________。
【答案】
(1)水分子间存在氢键;
(2)非极性;
(3)>;>;
(4)①能量最低原理;②直线形
【解析】
试题分析:(1)H2O与H2S都属于分子晶体,H2O分子间可以形成氢键,H2S只含有范德华力,所以水的沸点高于H2S的沸点,故答案为:水分子间存在氢键;
(2)非极性分子的溶质极易溶于非极性分子的溶剂,CCl4、CS2是非极性分子,CrO2Cl2能与CCl4、CS2等互溶,所以CrO2Cl2是非极性分子,故答案为:非极性;
(3)H2SO4和H3PO4分别为S、P元素的最高价氧化物对应的水化物,非金属性S>P,则酸性H2SO4>H3PO4;HClO4和HClO3都是Cl元素的含氧酸,Cl元素的化合价越高,酸性越强,则酸性:HClO4>HClO3,故答案为:>;>;
(4)①表中A、B两原子的第二、三电离能之间都有1个突跃,说明它们属于ⅡA族,又它们都是短周期元素,且A的第一电离能比B大,因此,A为Be元素,B为Mg元素,图1所示电子排布,根据能量最低原理,最外层两个电子应全排在s轨道上,故答案为:能量最低原理;
②A和氯元素形成的简单分子为BeCl2,BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线形,故答案为:直线形。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
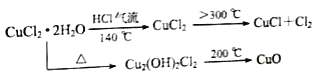
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)
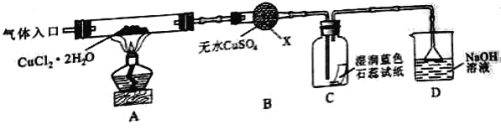
请回答下列问题:
(1)仪器X的名称是____________________.
(2)实验操作的先后顺序是a→_________→__________ → _________→e(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_________________.
(4)装置D中发生的氧化还原反应的离子方程式是____________________.
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是:_________________________.
②若杂质是CuO,则产生的原因是:_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
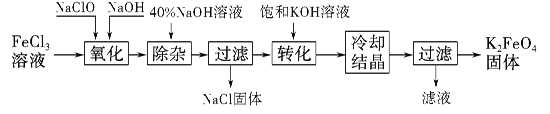
(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为 法。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为 g,要完成本实验该同学应称出 g NaOH。

(2)使用容量瓶前必须进行的一步操作是 。
(3)在配制过程中,其他操作都是正确的,下列操作会引起配制浓度偏高的是 。
A.转移溶液时不慎有少量洒到容量瓶外面 |
B.定容时俯视刻度线 |
C.未冷却到室温就将溶液转移到容量瓶并定容 |
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn的工艺流程如下,下列说法正确的是
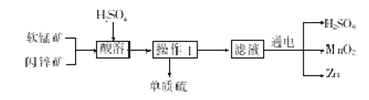
A.酸溶时,ZnS作氧化剂
B.硫酸可以循环使用
C.可用盐酸代替硫酸进行酸溶
D.MnO2和ZnS均属于盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。

(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色浑浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为________________;
实验Ⅱ.产品纯度的检测:
(3)已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL。①滴定终点的现象是 ;②该样品纯度是______________________;
(4)滴定过程中可能造成实验结果偏低的是___________________;
A.锥形瓶未用Na2S2O3溶液润洗
B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
实验Ⅲ.有毒废水的处理:
(5)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是:
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应有能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com