
【题目】工业上用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn的工艺流程如下,下列说法正确的是
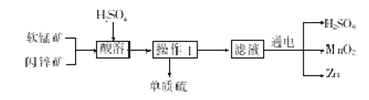
A.酸溶时,ZnS作氧化剂
B.硫酸可以循环使用
C.可用盐酸代替硫酸进行酸溶
D.MnO2和ZnS均属于盐
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法正确的是( )
A.点燃爆竹以后,硫燃烧生成SO3
B.福尔马林可以作食品保鲜剂
C.碳酸钠水溶液具有碱性,可用于制胃酸中和剂
D.中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.伴随着能量变化的物质变化都是化学变化
C.下图可表示Ba(OH)2·8H2O与NH4Cl晶体反应的能量变化
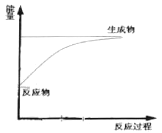
D.1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)D位于元素周期表第 周期 族。
(2)C和E两元素相比较,非金属性较强的是__________(填元素名称),可以验证该结论的是_________________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)写出C、D两元素形成的原子个数比为1:1的化合物与水反应的离子方程式: 。
(4)A与C间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式为 ;
(5)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______________;
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______________(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______________H3PO4; HClO4______________HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______________;
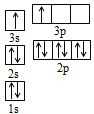
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,乙醛可发生分解:CH3CHO(l)![]() CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
反应Ⅰ:CH3CHO+ I2![]() CH3I2+HI+CO (慢)
CH3I2+HI+CO (慢)
反应Ⅱ:CH3I+HI![]() CH4+ I2
CH4+ I2
下列有关该反应的叙述中正确的是( )
A.反应速率与I2的浓度有关
B.HI在反应Ⅰ中是氧化产物
C.反应焓变的绝对值等于190kJ.mol-1
D.乙醛的反应速率主要取决于反应Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂。
(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______________.
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是_____(填字母)
A.最高正化合价:P>C
B.同温同浓度的两溶液的酸性:H3PO4>H2CO3
C.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去);
![]()
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热烈4.76kJ,则该反应的热化学方程式为_______________________________。
②已知M溶液中硫元素的主要存在形式为S2O32—,则反应Ⅲ中生成S2O32—的离子方程式为_______________.
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图像分析可知,a点时M溶液中除S2O32—外,还有______________(填含硫微粒的离子符号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com