
【题目】化学与生产生活密切相关,下列有关说法正确的是( )
A.点燃爆竹以后,硫燃烧生成SO3
B.福尔马林可以作食品保鲜剂
C.碳酸钠水溶液具有碱性,可用于制胃酸中和剂
D.中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知废旧干电池中的填充物主要有二氧化锰、炭黑、氯化锌、氯化铵、淀粉糊、Mn2O3、ZnO、FeO、汞的化合物等。某实验小组的同学拟回收废旧电池中的部份物质,主要操作流程如图:
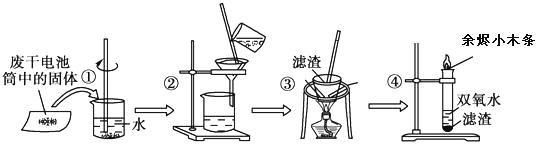
下列说法错误的是
A.步骤①的操作名称是溶解
B.步骤②中玻璃棒的作用是引流
C.步骤③的操作名称是蒸发
D.步骤④中的双氧水加入滤渣后迅速产生大量气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.CH3CO18OH与CH3OH发生酯化反应达到平衡后,18O仅存在于乙酸、水分子里
B.在体积可变的密闭容器中在一定条件下2molSO2和2molO2发生反应:2SO2(g)+O2![]() 2SO3(g),达到反应最大限度时,容器体积变为反应前的81.25%,则SO2转化率为70%。
2SO3(g),达到反应最大限度时,容器体积变为反应前的81.25%,则SO2转化率为70%。
C.对于任何化学反应来说,反应速率越快,反应现象不一定就越明显
D.某同学在用锌片与稀硫酸反应制取氢气时,向反应器中加入少量CuSO4固体(不考虑温度变化),则此时产生H2的化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
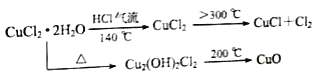
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)
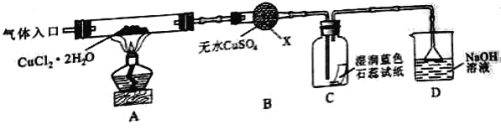
请回答下列问题:
(1)仪器X的名称是____________________.
(2)实验操作的先后顺序是a→_________→__________ → _________→e(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_________________.
(4)装置D中发生的氧化还原反应的离子方程式是____________________.
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是:_________________________.
②若杂质是CuO,则产生的原因是:_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe和Al是两种常用的金属,将它们按一定的质量比组成混合物。
(1)取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,则反应的离子方程式为: ___________________,混合物中的Al的物质的量为_______________.(用含字母的数学式表示)
(2)另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,则反应中转移电子的物质的量为____________.混合物中Fe的质量为____________________.(用含字母的数学式表示)
(3)向(2)所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体, 经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有两种气体单质Am和Bn。已知7.2g Am和6.3 g Bn所含的原子个数相同,分子个数之比却为2∶3。又知A原子中L电子层含电子数是K电子层的3倍。通过计算回答:写出B的元素名称______
(2) 向含0.1molFeBr2的溶液中通入0.1molCl2充分反应,反应的离子方程式为___________________(写成一个离子方程式)
(3)将192克铜投入1L浓度均为2mol/L硝酸、硫酸的混合酸,充分反应生成NO______L(标准状态下)(还原产物只有NO)
(4)取100克铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L;向所得的溶液中加入适量的2mol/L氢氧化钠溶液,则能得到沉淀最大值为______克
(5)将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+ 的物质的量随加入的KI的物质的量的变化关系如图所示,开始加入的KMnO4的物质的量为____________(附注:高锰酸钾将16H+ + 2MnO4- +10I- =5I2 +2Mn2+ +8H2O)
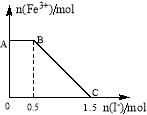
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
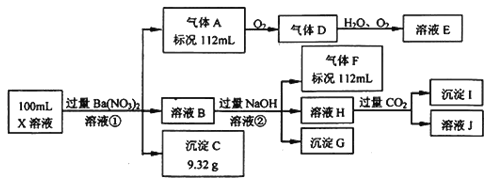
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 ,若要用实验证明该阴离子是否存在,最可靠的化学方法是 。
(2)气体F遇氯气产生白烟,写出此反应的化学方程式 。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0mL时开始产生沉淀,55mL时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60mL时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl-)为 mol/L。(若有些离子不存在,请填0mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn的工艺流程如下,下列说法正确的是
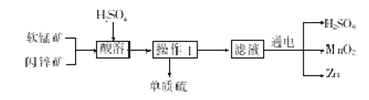
A.酸溶时,ZnS作氧化剂
B.硫酸可以循环使用
C.可用盐酸代替硫酸进行酸溶
D.MnO2和ZnS均属于盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com