
【题目】(1)有两种气体单质Am和Bn。已知7.2g Am和6.3 g Bn所含的原子个数相同,分子个数之比却为2∶3。又知A原子中L电子层含电子数是K电子层的3倍。通过计算回答:写出B的元素名称______
(2) 向含0.1molFeBr2的溶液中通入0.1molCl2充分反应,反应的离子方程式为___________________(写成一个离子方程式)
(3)将192克铜投入1L浓度均为2mol/L硝酸、硫酸的混合酸,充分反应生成NO______L(标准状态下)(还原产物只有NO)
(4)取100克铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L;向所得的溶液中加入适量的2mol/L氢氧化钠溶液,则能得到沉淀最大值为______克
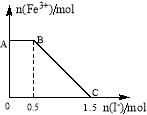
(5)将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+ 的物质的量随加入的KI的物质的量的变化关系如图所示,开始加入的KMnO4的物质的量为____________(附注:高锰酸钾将16H+ + 2MnO4- +10I- =5I2 +2Mn2+ +8H2O)
【答案】
(1)氮;
(2)2Fe2++ 2Br-+2Cl2=2Fe3++Br2+4Cl-
(3)33.6L;(4)253g;(5)0.3mol
【解析】
试题分析:(1)根据A原子的L层电子数是K层的3倍,可推知A是氧元素,Am中含A原子的物质的量为![]() =0.45 mol,则Bn中含B原子数也为0.45 mol,B元素的原子的摩尔质量=
=0.45 mol,则Bn中含B原子数也为0.45 mol,B元素的原子的摩尔质量=![]() =14 g/mol,故B元素为氮元素,故答案为:氮;
=14 g/mol,故B元素为氮元素,故答案为:氮;
(2) 1molFeBr2的溶液中通入1molCl2,先与亚铁离子反应,再与溴离子反应,其反应的离子方程式为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;故答案为:2Cl2+2Br-+2Fe2+=Br2+4Cl-+2Fe3+;
(3)n(Cu)=![]() =3mol,n(HNO3)=n(H2SO4)=2mol/L×1L=2mol,离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,该溶液中n(H+)=n(HNO3)+2n(H2SO4)=6mol,根据方程式知,如果3molCu完全溶解需要n(H+)为8mol>6mol,所以有部分Cu溶解,如果氢离子完全反应需要n(NO3-)=
=3mol,n(HNO3)=n(H2SO4)=2mol/L×1L=2mol,离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,该溶液中n(H+)=n(HNO3)+2n(H2SO4)=6mol,根据方程式知,如果3molCu完全溶解需要n(H+)为8mol>6mol,所以有部分Cu溶解,如果氢离子完全反应需要n(NO3-)=![]() ×2=1.5mol<2mol,因此氢离子完全反应,生成NO的物质的量==
×2=1.5mol<2mol,因此氢离子完全反应,生成NO的物质的量==![]() ×2=1.5mol,标准状况下的体积为1.5mol×22.4L/mol=3.36L,故答案为:33.6L;
×2=1.5mol,标准状况下的体积为1.5mol×22.4L/mol=3.36L,故答案为:33.6L;
(4)标准状态下,67.2LNO的物质的量为![]() =3mol,转移电子的物质的量=3mol×(5-2)=9mol,铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解后生成的金属阳离子,与氢氧化钠反应生成沉淀时结合的氢氧根离子的物质的量与转移的电子的物质的量相等,因此得到沉淀最大值=100g+9mo×17g/mol=253g,故答案为:253g;
=3mol,转移电子的物质的量=3mol×(5-2)=9mol,铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解后生成的金属阳离子,与氢氧化钠反应生成沉淀时结合的氢氧根离子的物质的量与转移的电子的物质的量相等,因此得到沉淀最大值=100g+9mo×17g/mol=253g,故答案为:253g;
(5)酸化的KMnO4溶液与FeSO4溶液混合后发生氧化还原反应,可知氧化性KMnO4>Fe3+;由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为高锰酸钾和碘化钾的反应,BC段为铁离子和碘化钾的反应。根据电子守恒有MnO4-~~5I-,故剩余的KMnO4的物质的量为0.1mol,根据电子守恒有MnO4-~~5Fe2+~~5Fe3+~~5I-,故与Fe2+反应的KMnO4的物质的量为0.2mol,故原来KMnO4的物质的量为0.3mol,故答案为:0.3mol。


科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l :1。
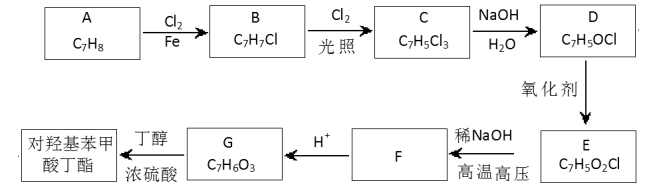
答下列问题:
(1)A的化学名称为 ;
(2)由B生成C的化学反应方程式为 ;
该反应的类型为 ;
(3)D的结构简式为 ;
(4)F的分子式为 ;
(5)G的结构简式为 ;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有 种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1,的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是 ( )
A.向待测液中先加入硝酸钡溶液有白色沉淀,再加入稀盐酸,白色沉淀不消失,可以确认待测液中含有SO![]()
B.向待测液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,可以确认待测液中含有NH![]()
C.向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认待测液中含有Fe2+
D.用玻璃棒蘸取待测液在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法正确的是( )
A.点燃爆竹以后,硫燃烧生成SO3
B.福尔马林可以作食品保鲜剂
C.碳酸钠水溶液具有碱性,可用于制胃酸中和剂
D.中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+.进行如下实验操作时最佳顺序为( )
①加入适量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液.
A. ①③ B. ③② C. ③① D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、N的原子序数依次增大,其中X的一种同位素原子没有中子,Y的一种核素可做考古学家测文物的年代,Z为地壳中含量最多的非金属元素,相同质量的W的单质在空气中缓慢氧化的产物与其在空气中燃烧产物不同,但转移的电子数相同,N原子为所在周期中原子半径最小的原子(稀有气体除外)。
(1)写出X元素没有中子的原子符号___________;Y与X形成的X元素的质量分数最高的分子的结构式___________;X、Z、N形成的原子个数比1:1:1的分子的电子式___________。
(2)用电子式表示W2Z形成过程___________;
(3)Z、W、N的简单离子半径从大到小的顺序___________(用离子符号表示);
(4)甲由上述元素X、Y元素形成的18电子分子,常温下是气态,可燃烧。
①甲分子中若两个H原子被Br取代,则可生成___________种溴代物;
②若把甲与氧气设计成燃烧电池(KOH溶液为电解质溶液),则负极反应的方程式为___________;放电一段时间后溶液的碱性___________(增强、减弱、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.伴随着能量变化的物质变化都是化学变化
C.下图可表示Ba(OH)2·8H2O与NH4Cl晶体反应的能量变化
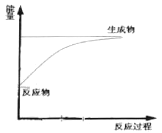
D.1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com