
分析 (1)尿液中含有葡萄糖;(2)蛋白质属于高分子化合物;
(3)医学上常用75%的乙醇溶液杀菌消毒;
(4)植物油和动物油均为油脂;
(5)家具材料中常含有甲醛和苯.
解答 解:(1)葡萄糖含有醛基,能和新制氢氧化铜悬浊液加热后反应生成有色沉淀,尿液中含有葡萄糖,故答案为:E;(2)天然的高分子化合物有淀粉、纤维素、蛋白质,故答案为:F;(3)75%乙醇具有使蛋白质变性而起到杀菌消毒的作用,故答案为:B;
(4)花生油、茶籽油的主要成分是油,牛油的主要成分是脂,但油和脂都属于油脂,故答案为:D;
(5)家具材料中常含有甲醛和苯,故答案为:A;
点评 本题考查了生活中常见有机化合物,运用化学知识解释生产、生活现象,学以致用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | b-a=m+n | B. | a+b=m+n | C. | a-b=m-n | D. | a-b=m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
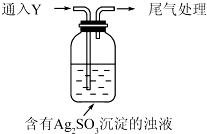
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| B. | 减少氟氯烃气体的使用,保护臭氧层免遭破坏 | |
| C. | 大量砍伐树木,制造生活必需品,从而降低物价,维持社会和谐 | |
| D. | 提倡每个人都要有“节能减排”的观念,在生活细节中也要点点滴滴地节约能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
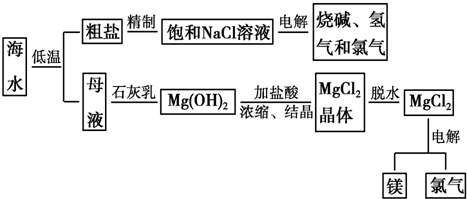
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 单质的氧化性减弱 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
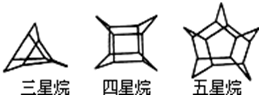
| A. | 三星烷与丙苯互为同分异构体 | B. | 五星烷的二氯取代物有8种 | ||
| C. | 六星烷的化学式为C18H24 | D. | 七星烷的一硝基取代物有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com