
分析 H2A在水中的电离方程式:H2A═H++HA-;HA-?H++A2-,其第一步完全电离,第二部电离可逆,HA-只电离不水解,
(1)强碱弱酸盐中阴离子水解导致溶液显示碱性,根据水解方程式的书写方法来回答;
(2)0.1mol•L-1H2A溶液,H2A?H++HA-,电离出H+小于0.1mol/L,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
(3)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离分析;
(4)根据溶液中的电荷守恒、物料守恒以及质子守恒来回答;
解答 解:(1)根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是:H2O+A2-?HA-+OH-,
故答案为:碱性;H2O+A2-?HA-+OH-;
(2)因为0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+;而0.1mol•L-1H2A溶液,H2A=H++HA-,电离出H+0.1mol/L和HA-0.1mol/L,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:小于;H2A第一步电离产生的H+,抑制了HA-的电离;
(3)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
(4)0.1mol•L-1的Na2A溶液中,A2-能够水解生成HA-,HA-不水解,
A、0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故A正确;
B、溶液中存在物料守恒c(Na+)=2c(A2-)+2c(HA-),故B错误;
C、HA-不水解质子守恒:c(OH-)=c(H+)+c( HA-),故C错误;
D、根据质子守恒:c(OH-)=c(H+)+c( HA-),故D正确;
故答案为:AD.
点评 本题考查学生盐的水解规律以及离子浓度之间的守恒关系等方面的知识,注意所学知识的灵活应用,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨气通入水中能得NH3•H2O | B. | 实验室用大理石与盐酸制取CO2 | ||
| C. | 久置的铁钉生锈 | D. | 蒸馏法将海水淡化为饮用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | c(CO) | c(H2O)(g) | c(CO2) | c(H2) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
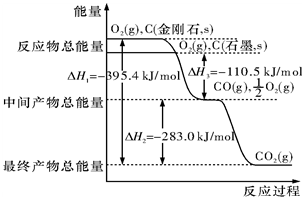 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱均会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加离子反应的一定都是电解质 | |
| B. | 任何一种离子的浓度在离子反应中一定变小 | |
| C. | 自由离子之间的反应不能在固态中进行 | |
| D. | 没有沉淀、气体、水生成的反应就不是离子反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com