
| A. | 参加离子反应的一定都是电解质 | |
| B. | 任何一种离子的浓度在离子反应中一定变小 | |
| C. | 自由离子之间的反应不能在固态中进行 | |
| D. | 没有沉淀、气体、水生成的反应就不是离子反应 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
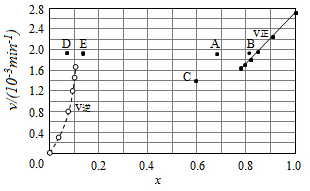 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
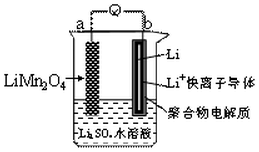 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com