
【题目】(1)甲烷重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程 | 化学方程式 | 焓变ΔH(kJ·mol-1) |
甲烷 氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | ΔH1 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | |
蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | +206.2 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | +165.0 |
①反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔH=________kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”“=”或“<”)。
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-570 kJ·mol-1 ①
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:___________。
(3)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的正极发生的反应是_______;负极发生的反应是________。
②在稀土氧化物的固体电解质中,O2-的移动方向是________。
【答案】-41.2 < CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-129kJ/mol O2+4e-=2O2- CH3OH+3O2--6e-=CO2↑+2H2O 正极移向负极
【解析】
(1)根据盖斯定律,由蒸汽重整的两个反应方程式叠加,就可得到待求的热反应方程式。反应物能量相等,生成物含有的能量越多,反应放出的热量就越少。
(2)将两个热化学方程式叠加,可得二氧化碳与氢气合成甲醇液体的热化学方程式;
(3)①燃料电池中依据原电池工作原理,正极是氧气得到电子发生还原反应,电解质是固体,氧气得到电子生成氧离子;甲醇在负极失电子,发生氧化反应生成二氧化碳;
②原电池中阴离子移向负极。
(1)由蒸汽重整的两个反应
①CH4(g)+H2O(g)=CO(g)+3H2(g),ΔH=+206.2kJ/mol
②CH4(g)+2H2O(g)=CO2(g)+4H2(g),ΔH=+165.0kJ/mol
根据盖斯定律②-①,整理可得反应:CO(g)+H2O(g)=CO2(g)+H2(g),△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol;
甲烷的燃烧热是1mol甲烷完全燃烧产生CO2气体和液态水时放出的热量,由于等质量的气态水含有的能量比液态水多,所以1mol甲烷反应产生液态水放出是热量比产生气态水放热多,反应放出的热量越多,反应热就越小,因此ΔH2<ΔH1;
(2)①2H2(g)+O2(g)=2H2O(l) ΔH=-570 kJ·mol-1
②CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1
根据盖斯定律①×![]() -②,整理可得CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-129kJ/mol;
-②,整理可得CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-129kJ/mol;
(3)①甲醇一空气燃料电池中,氧气在正极上得到电子,发生还原反应生成O2-,电极反应为:O2+4e-=2O2-;甲醇在负极失电子发生氧化反应,电极反应为:CH3OH+3O2--6e-=CO2↑+2H2O;
②依据电极反应分析可知原电池中阴离子移向负极,O2-从正极流向负极移动。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯(难溶于水,密度比水大的油状液体)的反应原理,下列关于硝基苯的制备和纯化的装置不正确的是
![]()
A. 浓硫酸与浓硝酸混合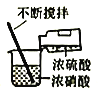
B. 制备硝基苯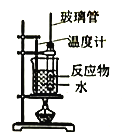
C. 用氢氧化钠溶液分离硝基苯中混有的酸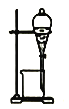
D. 分离硝基苯中混有的苯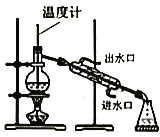
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或现象描述正确的是( )

A. 实验室用图1装置制备Cl2
B. 加热后图2中溶液颜色恢复红色
C. 用图3装置除去Cl2中含有的少量HCl
D. 实验室用图4装置制取少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以浓缩海水为原料提取溴的部分过程如下:

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。
(4)C装置的作用是___________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种重要的化工原料,其绿色化制备是重要的课题。某课外小组设计如下方案用锰酸钾制备高锰酸钾。
I. 锰酸钾制备。将二氧化锰、氯酸钾和氢氧化钾固体放入铁坩埚熔融制锰酸钾。
(1)搅拌时用___________(填“铁棒”或“玻璃棒”)。
(2)若要制得锰酸钾59.1g,至少需要氯酸钾___________g。
II. 高锰酸钾制备。制备高锰酸钾的装置如下图所示(加热与夹持装置省略)。
用I制得的锰酸钾加少量蒸馏水溶解,得墨绿色溶液,倒入三颈瓶中。打开甲装置分液漏斗活塞加入稀硫酸,加热,生成乙酸蒸气,通入乙装置,水浴加热,搅拌,锰酸钾在酸性条件反应生成高锰酸钾和二氧化锰。

(3)用离子方程式表示甲装置中存在的化学平衡___________(任写一个)。
(4)乙装置中发生反应的化学方程式:______________________。
(5)丙装置中氢氧化钠溶液的作用是______________________。
(6)甲装置容易发生倒吸,改进的措施是______________________。
(7)判断乙装置中锰酸钾完全反应的实验方法是;用玻璃棒蘸取溶液滴到滤纸上,若观察到______________________, 表示锰酸钾已完全反应。
III.高锰酸钾产品的纯度分析。
(8)将乙中所得溶液过滤,把滤液倒入蒸发皿中,浓缩,冷却,抽滤,洗涤,干燥得KMnO4产品。请设计实验证明产品中含有少量MnO2:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-),温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸(不考虑溶质挥发),溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
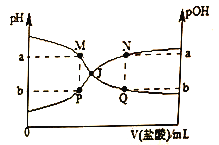
A. 曲线PJN表示溶液中pH的变化
B. 若M点水的电离程度与Q点相等,则Q点一定符合c(Cl-)>c(NH4+)+c(NH3·H2O)
C. M、P两点的数值之和a+b=14
D. pH与pOH交叉点J对应的V(盐酸)=20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+ 5/2O2(g) ![]() 2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1的说法中,正确的是 …( )
2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1的说法中,正确的是 …( )
A. 当10NA个电子转移时,该反应放出2600 kJ的能量
B. 当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C. 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com