
【题目】向容积为1.00L的密闭容器中通入一定量的N2O4和NO2的混合气体,发生反应:N2O4(g)![]() 2NO2(g)ΔH>0,体系中各物质浓度随时间变化如图所示。下列有关说法正确的是
2NO2(g)ΔH>0,体系中各物质浓度随时间变化如图所示。下列有关说法正确的是
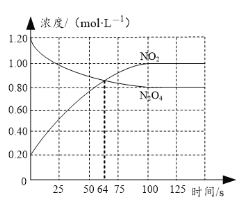
已知:NO2为红棕色气体,N2O4为无色气体
A.64s时,反应达到化学平衡状态
B.到达化学平衡前,混合气体的颜色逐渐变深
C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高
D.前100s内,用NO2浓度的变化表示的化学反应速率是0.008mol·L-1·s-1
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
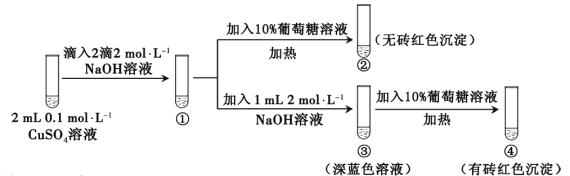
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
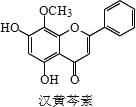
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某处工厂排出的烟道气中含氮氧化物(主要为NO、NO2)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
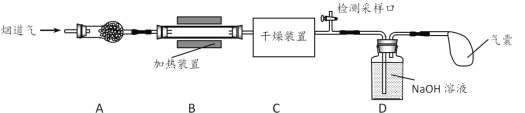
(1)装置A中放置无碱玻璃棉,其目的是除去___________。为保证检测的准确性,装置C中盛放的化学试剂可以是___________(填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
(2)装置D中主要发生:2NaOH+2NO2=NaNO2+NaNO3+H2O;2NaOH+NO+NO2=2NaNO2+H2O
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为_______(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3-,发生反应的离子方程式是___________。
(3)溶液中NO3-直接排放在水体中也会造成污染,现用活泼金属将溶液中NO3-转化为N2,实现氮元素的脱除,具体步骤如下:
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是___________。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因________。
(4)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理。HClO氧化NO生成NO3-和Cl-,发生反应的离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、W、X、Y、Z的原子序数依次增大,M与W形成的一种化合物是生活中的常见的清洁能源,Y的原子半径是所有短周期主族元素中最大的,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有淡黄色沉淀析出,同时有刺激性气体产生,回答下列问题:
(1)Y元素是____________(元素名称),X在周期表的位置为:__________。
(2)Y2Z2的电子式: ________________。
(3)X、Y、Z形成的盐与盐酸反应,有淡黄色沉淀析出,同时有刺激性气体产生的离子方程式:______________。
(4)Y2Z溶液的pH>7,其原因是(用离子方程式表示):__________________________。
(5)M2、WX的混合气体与空气构成碱性(KOH为电解质)燃料电池,若WX和M2体积比为1:2,W元素仅转化成MWX3-。负极总反应的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种无色液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知:2CH3OH(g)+O2(g)2CO2(g)+4H2(g)的能量变化如图所示,下列说法正确的是_____。(填字母)

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学反应不仅有新物质生成,同时也一定伴随能量变化
d.2mol甲醇和1mol氧气的总键能大于2mol二氧化碳和4mol氢气的总键能
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.4mol/L。则4min内平均反应速率v(H2)=_____,CH3OH的转化率为______。(转化率=某反应物转化浓度与该反应物起始浓度的百分比)
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。该燃料电池的总反应为CH3OH+O2+KOH=K2CO3+H2O(未配平)。回答下列问题:
①该电池的正极反应物为______。
②负极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与 4 mol·L-1的稀硫酸反应(放热反应)生成H2 的物质的量与反应时间的关系如图所示。下列结论正确的是( )
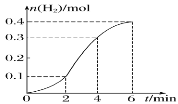
A.反应开始 2min 内平均反应速率最大
B.常温下,改用 98.3%的浓硫酸可以加快反应速率
C.反应在 2~4min 间生成 H2的平均反应速率为 0.1 mol·L-1·min-1
D.0~2min 内反应速率逐渐增大,说明 0~2min 内温度比浓度对反应速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com