


 MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
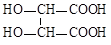 (2分)
(2分)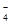 +5H2O2+6H+==2Mn2++5O2↑+8H2O(2分) ②28.3 %(2分)
+5H2O2+6H+==2Mn2++5O2↑+8H2O(2分) ②28.3 %(2分)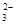 +6H2O(2分)
+6H2O(2分)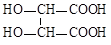
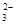 +6H2O
+6H2O

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:不详 题型:填空题
 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
 HCHO(g)+H2(g)
HCHO(g)+H2(g)| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定是吸热反应 |
| B.化学反应中的能量变化都表现为热量变化 |
| C.任何放热反应在常温下一定能发生反应 |
| D.反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1+Q2<Q3 | B.Q1+Q2>2Q3 |
| C.Q1+Q2=2Q3 | D.Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D.需要加热才能发生的化学反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中一定有物质变化,但不一定有能量变化 |
| B.CaO+H2O=Ca(OH)2是放热反应,说明CaO 的能量大于Ca(OH)2的能量 |
| C.Ba(OH)2·8H2O晶体与氯化铵晶体反应不需加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③ | C.①④⑤ | D.①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com