
【题目】金属钒(V)广泛应用于航空、化工、能源等行业。
(1)钒元素基态原子的电子排布式为__________,3d 能级上的未成对电子数为___________。
(2)VCl2溶液与乙二胺(H2N—CH2—CH3—NH4 )可形成配离子[V(En)2]2+ (En是乙二胺的简写),该配离子中所含非金属元素的电负性由大到小的顺序是___________ (用元素符号表示)。乙二胺分子中氮原子的杂化轨道类型为_____________,乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是______________。
(3)LiVH4是一种特殊的还原剂,可将乙酸直接还原成乙醇。CH3COOH和CH3CH2OH分子中σ键数目之比为 ____________。
(4)钒能形成多种配合物,钒的两种配合物 X、Y的化学式均为 V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来)。
X | X | Y | Y | |
试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则 X的配离子为___________,Y的配体是 __________。
(5)VO晶体的晶胞结构如图所示,VO晶体中 V2+的配位数为 __________________。若该晶胞边长为 b nm,则该晶体的密度为__________ (用含 b,NA的代数式表示)g·cm-3。

【答案】 1s22s22p63s23p63d34s2 {或[Ar]3d34s2 } 3 N>C>H sp3 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 7:8 [V(NH3)3Cl]2+ NH3、SO42- 6 ![]()
【解析】(1)V是23号元素,位于第四周期第IVB族,基态Ge原子核外电子排布式为1s22s22p63s23p63d34s2 {或[Ar]3d34s2 },在最外层的4s能级上2个电子为成对电子,3d轨道中3个电子分别处以不同的轨道内,有3个未成对电子;(2)VCl2溶液与乙二胺(H2N—CH2—CH3—NH4 )可形成配离子[V(En)2]2+ (En是乙二胺的简写),该配离子中所含非金属元素为H、C、N,N原子的2p轨道为半充满,较稳定,故电负性由大到小的顺序是N>C>H;乙二胺中N原子呈3个![]() 键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;乙二胺分子之间可以形成氢键,但三甲胺分子之间不能形成氢键;(3)CH3COOH分子中有7个σ键,CH3CH2OH分子中有8个σ键,则两者数目之比为7:8;(4)根据实验现象可知,X能电离出硫酸根离子,则X的配离子为[V(NH3)3Cl]2+,Y能电离出氯离子,则Y的配离子为[V(NH3)3 SO4] +,则配体是NH3、SO42-;(5)VO晶体的晶胞结构如图所示,VO晶体中与V2+最近相邻的O2-是6个,则V2+的配位数为6;钒原子在顶点和面心,个数为8
键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;乙二胺分子之间可以形成氢键,但三甲胺分子之间不能形成氢键;(3)CH3COOH分子中有7个σ键,CH3CH2OH分子中有8个σ键,则两者数目之比为7:8;(4)根据实验现象可知,X能电离出硫酸根离子,则X的配离子为[V(NH3)3Cl]2+,Y能电离出氯离子,则Y的配离子为[V(NH3)3 SO4] +,则配体是NH3、SO42-;(5)VO晶体的晶胞结构如图所示,VO晶体中与V2+最近相邻的O2-是6个,则V2+的配位数为6;钒原子在顶点和面心,个数为8![]() +6
+6![]() =4,氧原子在棱和体心,个数为12
=4,氧原子在棱和体心,个数为12![]() +1=4,则一个晶胞相当于4个VO,其密度为ρ=
+1=4,则一个晶胞相当于4个VO,其密度为ρ=![]() =
=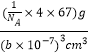 =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入a mol H2和a mol Br2,在一定温度和压强下发生反应:
Br2(g)+ H2(g)![]() 2HBr(g)Δ< 0。当改变下列条件时,请填上相应变化。
2HBr(g)Δ< 0。当改变下列条件时,请填上相应变化。
(1)保持容器容积不变,向其中加入a mol He(He不参与反应),则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变”或“无法确定”)。平衡将____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”)。
(2)保持容器内气体压强不变,向其中加入a mol He(He不参与反应),则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变” 或“无法确定”)。平衡将____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”)。
(3)保持容器容积不变,向其中加入a mol H2,则该反应的正反应速率(V正)__________,逆反应速率(V逆)___________(填“增大”或“减小”或“不变”)。平衡____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”)。
(4)将容器体积压缩为原来一半,则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变” 或“无法确定”); 平衡____________(填“向左移动”或“向右移动”或“不移动” 或“无法确定”);容器内气体颜色_________填“变深”或“变浅”或“不变” 或“无法确定”);
(5)保持容器容积不变,将生成的HBr移走一部分,则该反应的正反应速率(V正)_______________,逆反应速率(V逆)_______________(填“增大”或“减小”或“不变”)。平衡将____________(填“向左移动”或“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在进行分液操作实验时需用到的玻璃仪器是烧杯和_______,在进行分液时,首先要对其进行________。
II、下图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。

(l)图中有两处明显的错误是:①__________;②___________。
(2)A仪器的名称是__________;B仪器的名称是__________。
(3)实验时A中除加入少量自来水外,还需要加入少量的_______,其作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应N2+3H2==2NH3中,其他条件不变的情况下,降低温度平衡向正反应方向移动,为 ________ 反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是 _________ (填写编号).

a.增大N2的浓度
b.扩大容器体积
c.加入催化剂
d.升高温度
改变条件后,平衡混合物中NH3的百分含量 ______ (选填“增大”、“减小”、“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定有SiO2,控制pH是为了使Al3+转化为Al(OH)3进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是( )
A. 由溴乙烷水解制乙醇;由葡萄糖发酵制乙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 乙烯水化制乙醇;溴乙烷水解制乙醇
D. 油脂皂化;蛋白质水解制氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙醇和乙酸中都存在碳氧双键
B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾可以氧化苯和甲烷
D.乙烯可以与氧气发生加成反应,苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)组成蛋白质的氨基酸几乎都是α-氨基酸,写出最简单的α-氨基酸的结构简式 ________________。
(2)有机物 的分子式为_________________。
的分子式为_________________。
(3)某烃的分子量为72,跟氯气反应生成的一氯代物只有一种,该烃的结构简式为_________________。
(4)C7H8O属于芳香族化合物且能发生催化氧化反应,该反应方程式为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com