
【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO2

C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3 具有热不稳定性
D. 充分反应后,锥形瓶内有 NO3-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加amL0.1mol/L稀盐酸,至溶液的pH=7。
下列说法正确的是
A.①中溶液的pH=1
B.②中反应后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反应后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学热力学是物理化学的重要分支。请根据所学知识回答下列问题:
(1)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
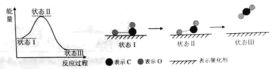
①CO和O生成CO2是______反应(填吸热或放热)
②状态Ⅲ生成的分子含有____(填极性键或非极性键),该分子的电子式____
(2)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。(填=、>或<)
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。(填=、>或<)
(3)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。(填=、>或<)
(4)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,

反应①为2HCl(g) + CuO(s) =H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2
则总反应的热化学方程式为_______, (反应热用△H1和△H2表示)。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的ΔH=________
(6)乙苯催化脱氢制苯乙烯反应:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项实验基本操作中,正确的是
A. 为了加快锌和稀硫酸反应的速率,可以向稀硫酸中加入少量硫酸铜![]()
B. 在做中和滴定实验时清洗滴定管后,直接装液滴定
C. 为了加快过滤速度,用玻璃棒搅拌过滤器中的液体
D. 为了使配制的氯化铁溶液保持澄清,加入盐酸和铁片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1molHCHO分子中含有σ键的数目为3mol
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为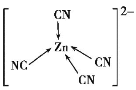
查看答案和解析>>
科目:高中化学 来源: 题型:
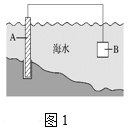
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择______(填字母)。
a.碳棒 b.锌板 c.铜板
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
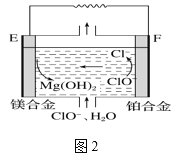
①E为该燃料电池的______(填“正”或“负”)极。F电极上的电极反应式为_________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学方程式解释其原因______________________。
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
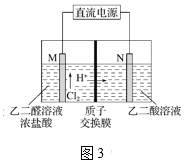
①N电极上的电极反应式为_____________。
②若有2 molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助于李比希法、现代科学仪器及化学实验可以测定有机物的组成和结构。实验兴趣小组用如下图所示的装置测定某有机物X(含元素C、H、O中的两种或三种)的组成。实验测得样品X消耗的质量为1.50g,高氯酸镁质量增加0.90g,碱石棉质量增加2.20g。
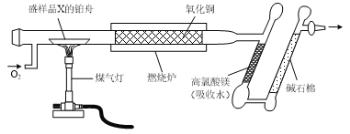
(1)由实验数据分析计算可得X的实验式为_____。
(2)若红外光谱测得X中含有“C=O”和“C-O-C”的结构,质谱法测得X的相对分子质量是60,则X的名称为_______。
(3)若实验测得相同状况下,X蒸汽的密度是H2密度的45倍(已知相同状况下,气体的密度比等于摩尔质量之比),X能发生银镜反应,1mol X最多能与2mol Na发生反应。则X的结构简式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com