
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去).请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
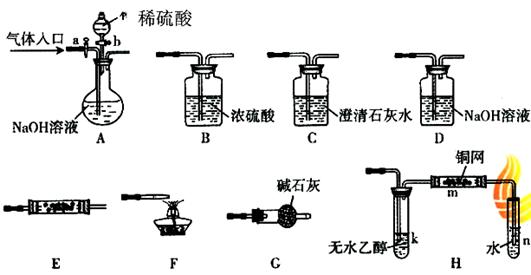
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为___________(填代号)。能验证CO氧化产物的现象是__________________________________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应___________,活塞b应___________,需要加热的仪器装置有____________(填代号),m中反应的化学方程式为___________________.
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体.E内放置铂铑合金网,按A→C→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:______________________________________。
②实验中观察到E内有红棕色气体出现.证明氨气具有_________性。
【答案】
(1)ACBECF
AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊
(2) 打开 k m
2CH3CH2OH+O2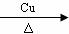 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。
还原
【解析】本题为实验题,主要考查物质除杂、性质及实验步骤。
(1)分离提纯CO、CO2混合气体,先除去CO2,再检验CO2是否除净,干燥CO,CO与CuO反应氧化为CO2,最后检验生成的CO2,未反应的CO一定要处理,一般是点燃或收集。


科目:高中化学 来源: 题型:
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
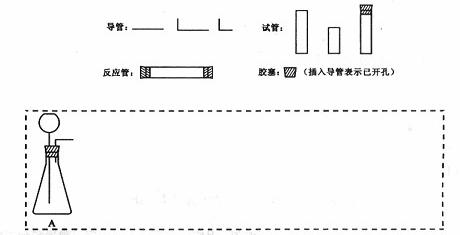
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和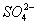 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
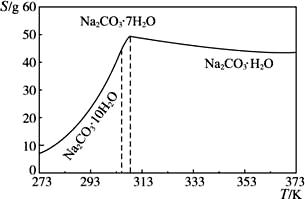
回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如下图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:

(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+ +
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
。
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可行的是
A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质
B.用NaOH溶液除去CO2中混有的HCl气体
C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
D.用乙醇从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+_____KI+_____H2SO4====_____K2SO4+_____I2+______H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_______________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________________。
(3)已知:I2+2SO32-====2I-+ SO42-。
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________________。
②b中反应所产生的I2的物质的量是______________________________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_____________mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是____________________________________。
⑶当步骤2中的溶液pH=8~9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH较难控制,可改用____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.等物质的量的甲基(—CH3)与羟基(—OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NH 所含质子数相等
所含质子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com