
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
分析 AgNO3可与CaCl2、HCl和Na2CO3均反应生成沉淀,B+D有气体生成,则B、D分别为HCl、Na2CO3中的一种,A+B无现象,可知A、B分别为CaCl2、HCl中的一种,则B为HCl,以此来解答.
解答 解:AgNO3可与CaCl2、HCl和Na2CO3均反应生成沉淀,B+D有气体生成,则B、D分别为HCl、Na2CO3中的一种,A+B无现象,可知A、B分别为CaCl2、HCl中的一种,则B为HCl,A为CaCl2,D为Na2CO3,C为AgNO3,符合实验③④中沉淀生成,
(1)由上述分析可知A为CaCl2,故答案为:CaCl2;
(2)B与D反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
(3)A与B不发生反应的理由不满足离子反应的条件(或无气体、水、沉淀生成),故答案为:不满足离子反应的条件.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
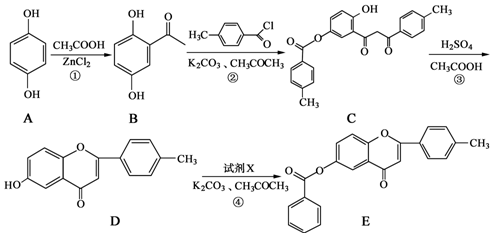
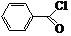 .
.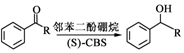 .
.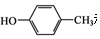 和CH3COOH为原料制备
和CH3COOH为原料制备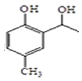 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
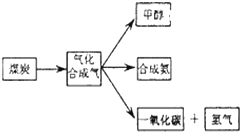
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
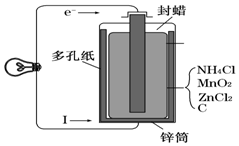 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
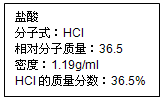 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.42mol•L-1 | B. | 0.21mol•L-1 | C. | 0.56mol•L-1 | D. | 0.24mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
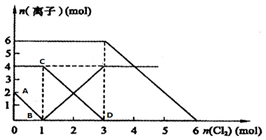 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com