
【题目】X(g)+3Y(g) ![]() 2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
A.10min内,消耗0.2 mol X,生成0.4 mol Z
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
D.10min内,X和Y反应放出的热量为a kJ
【答案】A
【解析】
用“三行式”解题,注意平均速率与瞬时速率的差别,正确理解可逆反应热化学方程式的含义。
X(g)+3Y(g) ![]() 2Z(g) ΔH=-a kJ·molˉ1
2Z(g) ΔH=-a kJ·molˉ1
起始/mol: 1 3 0
转化/mol: 0.2 0.6 0.4
10min/mol: 0.8 2.4 0.4
A. 上述数据说明,10min内消耗0.2 mol X、生成0.4 mol Z,A项正确;
B. 10min内,X的平均反应速率为0.2mol/(2L×10min)=0.01 mol·Lˉ1·minˉ1,不是第10min时的瞬时反应速率,B项错误;
C. 10min内,Y的平均反应速率v(Y)=3v(X)=0.03 mol·Lˉ1·minˉ1=0.0005mol·Lˉ1·sˉ1,C项错误;
D. 题中热化学方程式表明,1molX与3molY完全反应生成2molZ时放热akJ。10min内,有0.2molX和0.6molY发生反应,故放热0.2a kJ,D项错误。
本题选A。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
A. 加催化剂,V正、V逆都发生变化,且变化的倍数相等
B. 加压,V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数
C. 降温,V正、V逆都减小,且V正减小的倍数大于V逆减小的倍数
D. 增大氮气的浓度,V正、V逆都增大,且V正增大倍数大于V逆 增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍是工业上提纯镍的主要方法,其原理为:Ni(s)+4CO(g) ![]() Ni(CO)4(g) △H<0。已知:Ni(CO)4的沸点为42.2℃,230℃时该反应的平衡常数K=2×10—5,固体杂质不参与反应。
Ni(CO)4(g) △H<0。已知:Ni(CO)4的沸点为42.2℃,230℃时该反应的平衡常数K=2×10—5,固体杂质不参与反应。
第一阶段:调控温度使粗镍与CO反应,转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,调控温度制得高纯镍。
下列判断正确的是
A. 第一阶段将粗镍粉碎有利于平衡正向移动
B. 第二阶段可以选择230℃
C. 第一阶段的温度高于第二阶段的温度
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是三种有机物的结构简式,下列说法正确的是( )
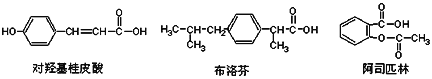
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 三种物质中,其中有两种互为同分异构体
D. 三种物质在一定条件下,均可以被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com