
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题。

(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A,还可制取的无色气体是________(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管中有无色无味的气体产生,上述现象证明NH3具有________性,写出相应的化学方程_ 。
(4)装置E中浓硫酸的作用是_______________________。
(5)读取气体体积前,应对装置F进行的操作:_____________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比值为________(用含m、n字母的代数式表示)。
【答案】(1)分液漏斗;生石灰(氧化钙或氢氧化钠固体或碱石灰)
(2)BC
(3)还原;3CuO+2NH3![]() 3Cu+3H2O+N2
3Cu+3H2O+N2
(4)吸收未反应的氨气,阻止F中水蒸气进入D
(5)慢慢上下移动右边漏斗,使左右两管液面相平
(6)![]()
【解析】
试题分析:(1)装置中仪器a为分液漏斗;仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体,故答案为:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;
(2)利用装置A,可制取的无色气体;A.制备氯气Cl2需要加热,且氯气为黄绿色气体,故A不符合;B.可以制备O2,利用固体过氧化钠和水的反应,故B符合;C.可以制备CO2 气体,利用稀盐酸滴入大理石上反应生成,故C符合;D.NO2是红棕色气体,故D不符合;故选BC;
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为:3CuO+2NH3![]() 3Cu+3H2O+N2 ,故答案为:还原;3CuO+2NH3
3Cu+3H2O+N2 ,故答案为:还原;3CuO+2NH3![]() 3Cu+3H2O+N2 ;
3Cu+3H2O+N2 ;
(4)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(5)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数,故答案为:慢慢上下移动右边漏斗,使左右两管液面相平;
(6)若测得干燥管D增重mg为水物质的量=![]() ,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=
,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=![]() ,依据元素守恒得到氮原子和氢原子物质的量之比=
,依据元素守恒得到氮原子和氢原子物质的量之比=![]() ×2:
×2:![]() ×2=
×2=![]() ,则氨分子中氮、氢的原子个数比为
,则氨分子中氮、氢的原子个数比为![]() ,故答案为:
,故答案为:![]() .
.


科目:高中化学 来源: 题型:
【题目】本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S![]() HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
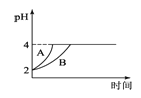
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的__ 。
(2)根据下列描述写出下列化学方程式:
①已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素【CO(NH2)2】和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(19分)Ⅰ.实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.
(1)应用托盘天平称量NaCl g,应用10mL量筒量取H2SO4 mL;
(2)配制两种溶液时都需要的仪器是 ;
(3)稀释浓H2SO4时应注意 ;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、容量瓶刚用蒸馏水洗净,没有烘干
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
H、容量瓶加水定容时俯视刻度线
Ⅱ.为了测定已部分变质的过氧化钠样品的纯度(质量百分含量),设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中。按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。

请回答下列问题:
(1)Q内发生反应生成________种气体,其中的反应有________个为氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”),打开______(填“K1”、“K2”或“K3”)。
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是 。
(4)b中装的固体试剂是__________,需缓缓打开K1的原因为 。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是 (用含x、y的式子表示,上述体积均已折算成标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
__Cr2O72-+__SO32-+__ □=__Cr3++__SO42-+ __H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
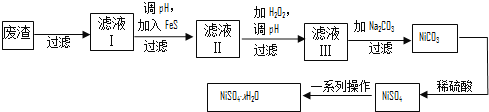
![]() ①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol羟基中含有的电子数为0.9 NA
B.标准状况下,12g金刚石中含共价键的数目为4NA
C.0.1 mol N2与足量H2充分反应,转移的电子数为0.6 NA
D.235g核素![]() 发生裂变反应:
发生裂变反应:![]() 净产生的中子(
净产生的中子(![]() )数为10NA
)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成,现利用如图所示流程,以环己烯为原料合成环醚、聚酯和合成橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1HC=CHR2→R1-CHO+R2-CHO
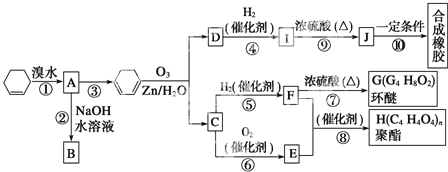
(1)③的反应条件是_______________________。
(2)H的名称是_________________________。
(3)有机物B和I的关系为_____(填序号)。
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(4)写出反应⑩的化学方程式:________________。
(5)写出两种D的属于酯类的链状同分异构体的结构简式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
【提出假设】假设1:气体产物只有SO2; 假设2:_____________;
【实验设计】为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应.

(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后_____________,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象.反应后硫酸盐中金属显+2价.写A中发生反应的化学方程式_____________;
(3)若假设2正确,则可观察到:F管中_____________;G干燥管里_____________;
【实验反思】为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液.稀释烧瓶里溶液的操作方法_______;
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去;所以可得到此条件下对金属M与浓硫酸反应的气体产物的探究假设 ________成立。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com