
【题目】下列说法正确的是( )。
A.金属氧化物一定是碱性氧化物B.碱性氧化物不一定是金属氧化物
C.酸性氧化物一定是非金属氧化物D.非金属氧化物不一定是酸性氧化物
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法正确的是
A. c(NH![]() ):③<①
):③<①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(Cl-)>c(NH![]() ) >c(OH-)>c(H+)
) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )
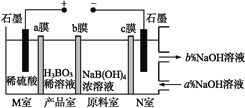
A. M室发生的电极反应式:2H2O-4e-![]() O2↑+4H+
O2↑+4H+
B. N室:a<b
C. 产品室发生的反应是B(OH)4- +H+![]() H3BO3+H2O
H3BO3+H2O
D. 理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X是直流电源。Y烧杯中c、d为石墨棒,Z烧杯中e、f是质量相同的铜棒。接通电路后,发现d附近溶液显红色。

(1)①电源b极为________(填“正”“负”或“阴”“阳”,下同)极。
②Z烧杯中e为________极。
③连接Y、Z烧杯线路中,电子流动的方向是d________(填“→”或“←”)e。
(2)①写出Y烧杯中c极上的电极反应式:_______________________________
②写出Y烧杯中总反应的化学方程式:________________________________
③写出Z烧杯中e极上的电极反应式:_______________________________
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______mol。
②若Y烧杯中溶液体积为500 mL(电解后体积可视为不变),电解反应的速率v(OH-)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
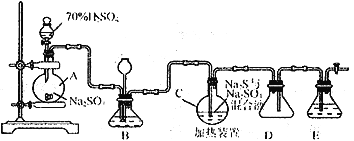
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
![]()
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如下图所示
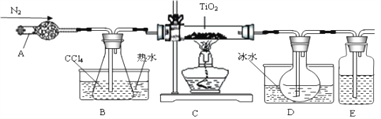
有关物质的性质如下表
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
下列说法正确的是
A. A和E分别盛装碱石灰和氢氧化钠溶液
B. 点燃C处酒精灯后再往A中通入N2
C. TiCl4遇潮湿空气反应的化学方程式:TiCl4+3H2O=H2TiO3+4HCl
D. 分离D中的液态混合物,所采用操作的名称是萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将V1 L 0.1mol/L NaOH溶液与V2 L 0.6mol/L NaOH溶液混合,所得溶液浓度为0.3mol/L,如果混合后的体积为混合前的体积和,V1:V2=( )
A.1:2
B.2:1
C.3:2
D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com