
【题目】某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程. 【实验】在0.1molL﹣l MgSO4 , 0.05molL﹣l﹣Al2( SO4)3的混合溶液中滴加0.5mol.L﹣1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 .
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3: 推测l:生成Mg( OH)2沉淀,消耗OH ﹣;
推测2:;
推测3.
若推测l符合实际情况,则a点之前反应的离子方程式为一,请据此描述Mg( OH)2 , A1( OH)3两种物质在水溶液中溶解性的差异.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
较大量存在的含金属元素的离子 | 检验方法 |
【答案】
(1)碱式滴定管
(2)生成白色沉淀并逐渐增多
(3)生成Al(OH)3沉淀消耗OH﹣;Al(OH)3沉淀溶解,消耗OH﹣
(4)Na+;用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+;[Al(OH)4]﹣;取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解
【解析】解:(1)精确控制加入NaOH溶液的体积,应用精确度0.01ml的滴定管,又NaOH呈碱性,故选用碱式滴定管,所以答案是:碱式滴定管;(2)由图象可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH﹣;生成Al(OH)3沉淀消耗OH﹣; Al(OH)3沉淀溶解,消耗OH﹣三种可能,第一阶段(a点前)应该是生成沉淀消耗了滴下去的氢氧化钠,故现象为:生成白色沉淀并逐渐增多,所以答案是:生成白色沉淀并逐渐增多;(3)根据分析可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH﹣;生成Al(OH)3沉淀消耗OH﹣; Al(OH)3沉淀溶解,消耗OH﹣三种可能,若推测1符合实际情况,b、c之间生成Mg(OH)2沉淀,消耗OH﹣ , 则a点之前应该是产生氢氧化铝的反应,所以反应的离子方程式为Al3++3OH﹣═Al(OH)3↓,据此说明在碱性溶液中铝离子比镁离子更易沉淀,所以Al(OH)3比Mg(OH)2更难溶于水, 故答案:生成Al(OH)3沉淀消耗OH﹣;Al(OH)3沉淀溶解,消耗OH﹣;Al3++3OH﹣═Al(OH)3↓;Al(OH)3比Mg(OH)2更难溶于水;(4)根据以上分析得出,e点前的反应为Al(OH)3+OH﹣═Al(OH)4﹣ , 所以e点后溶液中较大量存在的含金属元素的离子为钠离子和Al(OH)4﹣离子,所以答案是:
较大量存在的含金属元素的离子 | 检验方法 |
Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
[Al(OH)4]﹣ | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |


科目:高中化学 来源: 题型:
【题目】氢氧化铁胶体制备步骤如下:
①用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾;
②向烧杯中逐滴加入饱和FeCl3溶液;
③继续煮沸至液体是透明的红褐色,即得Fe(OH)3胶体.
回答下列问题:
(1)写出制备Fe(OH)3胶体的化学方程式;
(2)如何确定你制备胶体是否成功?;
(3)若向Fe(OH)3胶体中逐滴加入H2SO4溶液至过量会出现的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)=3Ca2+(aq)+2PO43﹣(aq)
①溶度积Ksp=;
②若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 molL﹣1 , c(PO43﹣)=1.58×10﹣6 molL﹣1 , 则Ksp= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究HClO的漂白性,某同学设计如下的实验:
(1)通入氯气后,从集气瓶A中干燥的红色布条的现象可得出的结论是;从集气瓶B中湿润的红色布条的现象可得出的结论是 , 其中氯气发生反应的化学方程式为 .
(2)烧杯中所盛的试剂为 , 其作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化铵 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
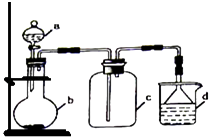
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下.
提出猜想:
问题1:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题2:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ.解决问题1取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式: ,
(2)从实验Ⅰ可得出的结论是
(3)Ⅱ.解决问题2
设计如下装置(夹持装置未画出):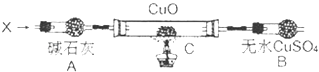
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g单质气体Y.
X气体的摩尔质量是 .
(4)C中发生反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com