
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO32-)+c(CO32-)<0.1 mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO32- )>c(H2CO3)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列有关实验原理、操作或现象不正确的是( )
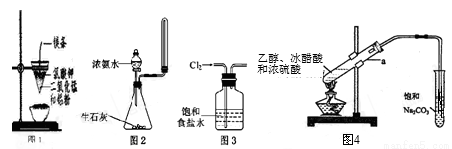
A.图1装置可制得金属锰,用同样的装置可制得金属铬
B.实验室用图2所示装置制取少量氨气
C.实验室用图3所示装置除去Cl2中的少量HCl
D.实验室用图4所示装置制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2016届福建厦门外国语学校高三5月月考理综化学试卷(解析版) 题型:填空题
研究NOx、CO等大气污染气体的处理及利用的方法具有重要意义,可实现绿色环保、节能减排、废物利用等目的。
(1) 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
H2(g)+CO2(g),500℃时的平衡常数为9,若在该温度下进行,设起始时CO和H2O的起始浓度均为0.020 mol·L-1,则CO的平衡转化率为: 。
(3) 用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。


①写出总反应化学方程式 。
②测得该反应的平衡常数与温度的关系为:lgK=5.08+217.5/T,该反应是 反应(填“吸热”或“放热”)。
③该反应的含氮气体组分随温度变化如图2所示,当温度达到700K时,发生副反应的化学方程式 。
(4)下图是用食盐水做电解液电解烟气脱氮的一种原理图,NO被阳极产生的氧化性物质氧化为NO3—,尾气经氢氧化钠溶液吸收后排入空气。如下图,电流密度和溶液pH对烟气脱硝的影响。


①NO被阳极产生的氧化性物质氧化为NO3-反应的离子方程式 。
②溶液的pH对NO去除率影响的原因是 。
③若极板面积10cm2,实验烟气含NO 1.5%,流速为0.070L·s-1(气体体积已折算成标准状态,且烟气中无其他气体被氧化),法拉第常数为96500 C·mol-1,测得电流密度为1.0 A·cm-2。列式计算实验中NO除去率 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
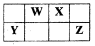
A.W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B.Z元素的最高价氧化物水化物的酸性强于Y
C.四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D.向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:简答题
【化学—选修3: 物质结构与性质】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。
该合金的晶胞结构如图所示。
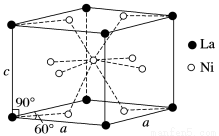
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:选择题
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ?mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ?mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ?mol—1,PCl3中P-Cl键的键能为1.2c kJ?mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能(已知键能跟原子半径有关,原子半径越大,形成的共价键键能越小)
B.可求Cl2(g)+ PCl3(g)=PCl5(s)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ?mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ?mol—1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
下列各组物质中,不能按a→b→c关系相互转化的是(“→”表示一步完成)
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | Na | Na2O2 | NaOH |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高二6月学业调研化学试卷(解析版) 题型:推断题
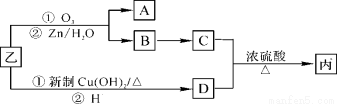
植物精油具抗菌消炎、解热镇痛之功效。从樟科植物叶中提取的精油中含有甲、乙、丙三种成分。
I、甲经下列过程可转化为乙:
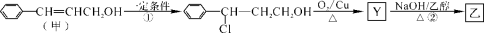
(1)甲中官能团的名称为 。乙的结构简式为 。1 mol乙最多可与 mol H2反应。
II、通过下列合成路线由乙可得丙(部分反应产物略去):
已知下列信息:①RCH=CHR’  RC
RC HO+R’CHO
HO+R’CHO
②丙的分子式为C16H14O2,能与溴水、NaOH溶液反应。
(2)B→C的反应类型是 ;A的结构简式是 。
(3)乙与新制Cu(OH)2悬浊液反应的化学方程式为 。
(4)C与D生成丙的化学方程式 。
(5)写出同时符合下列要求的D的同分异构体的结构简式 。
a.属于二取代苯
b.分子中有不同化学环境的氢原子5种,其个数比为1∶1∶2∶2∶2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
Ⅲ、已知:
(6)OHC-COOH有多种合成方法,请写出由乙酸合成OHC-COOH的路线流程图(其他原料任选)合成路线流程图示例如下:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com