
| A. | 将0.l mol•L-1醋酸溶液加水稀释,溶液中所有离子的浓度都减小 | |
| B. | 0.1 mol/L的一元弱酸HA加水稀释过程中,$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$ 不变 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 中和10 mL 0.1mol•L-1醋酸与中和100 mL 0.01mol•L-1的醋酸所需同种碱液的量不同 |
分析 A.加水稀释醋酸,氢离子浓度减小,但氢氧根离子浓度增大;
B.已知Kw=c(H+)•c(OH-),Ka=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$,由$\frac{Ka}{Kw}$=$\frac{c({A}^{-})}{c(HA)c(O{H}^{-})}$;
C.醋酸是弱酸存在电离平衡,PH相同的盐酸和醋酸,醋酸溶液浓度大于盐酸;
D.10 mL 0.1mol•L-1醋酸与100 mL 0.01mol•L-1的醋酸溶液中溶质物质的量相同.
解答 解:A.加水稀释醋酸,氢离子浓度减小,温度不变溶液中离子积常数不变,氢氧根离子浓度增大,故A错误;
B.已知Kw=c(H+)•c(OH-),Ka=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$,由$\frac{Ka}{Kw}$=$\frac{c({A}^{-})}{c(HA)c(O{H}^{-})}$,已知Ka和Kw均为常数,所以$\frac{c({A}^{-})}{c(HA)c(O{H}^{-})}$不变,故B正确;
C.醋酸是弱酸存在电离平衡,PH相同的盐酸和醋酸,醋酸溶液浓度大于盐酸,中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量醋酸大于盐酸,故C错误;
D.10 mL 0.1mol•L-1醋酸与100 mL 0.01mol•L-1的醋酸溶液中溶质物质的量相同,中和10 mL 0.1mol•L-1醋酸与中和100 mL 0.01mol•L-1的醋酸所需同种碱液的量相同,故D错误;
故选B.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意酸的电离平衡常数、水的离子积常数只与温度有关,与溶液的浓度无关,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 18O、31P | B. | 1H、12C | C. | 14N、23Na | D. | 24Mg、32S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
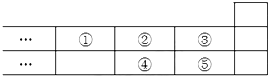
| A. | 元素①位于第二周期第IVA族 | |
| B. | 元素的最高正价是③=⑤ | |
| C. | 最高价氧化物对应水化物的酸性:③>⑤>④ | |
| D. | 气态氢化物的稳定性:④<②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂蒸发快,得到的晶体颗粒也较大 | |
| B. | 减压过滤可过滤胶状沉淀物,且较为干燥 | |
| C. | 由0.1 mol•L-1一元碱BOH溶液的pH=10,可推知BOH溶液有BOH═B++OH- | |
| D. | 由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液有A-+H2O?HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
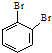 和
和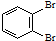
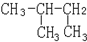 和
和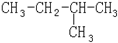
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com