
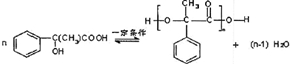
 生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.
生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.分析 利用原电池装置对金属Fe进行防护,Fe应为原电池的正极,氢离子在Fe表面发生还原反应生成氢气,比Fe活泼的金属作负极,溶液中的阴离子移向负极,反应物能量高于生成物时,反应放热,据此分析.
解答 解:(1)利用原电池装置对金属Fe进行防护,Fe应为原电池的正极,比Fe活泼的金属作负极,如图: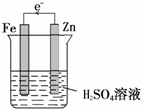 ,
,
故答案为: ;
;
(2)Fe为原电池的正极,氢离子在Fe表面发生还原反应生成氢气,溶液中的阴离子移向负极,故答案为:正;还原;2H++2e-=H2↑;负;
(3)反应物能量高于生成物时,反应放热,故答案为:<.
点评 本题考查了金属的电化学防护、原电池原理、焓变与反应物生成物能量的关系,知识较基础,题目难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
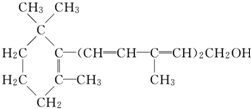
| A. | 维生素A是一种醇 | |
| B. | 维生素A的一个分子中含有三个碳碳双键 | |
| C. | 维生素A的一个分子中有33个氢原子 | |
| D. | 维生素A不能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
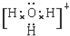 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是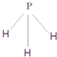 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c | B. | 离子半径:Yn->Zm- | ||
| C. | a-b=m-n | D. | 原子核外最外层电子数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
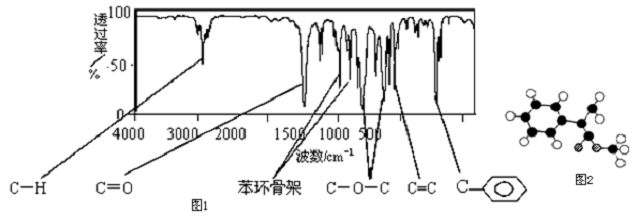
 (包括顺反异构)
(包括顺反异构)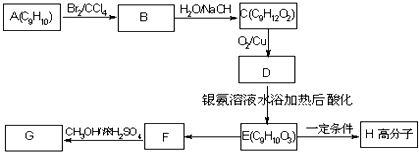
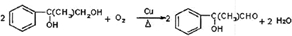
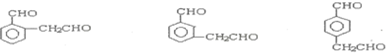 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂 | |
| B. | 硅酸钠用于制备硅胶和木材防火剂的原料 | |
| C. | 用热的纯碱溶液洗涤油污 | |
| D. | 明矾可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com