
【题目】已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
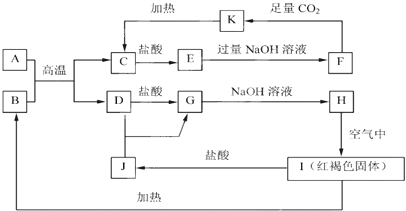
请回答以下问题:
(1)B的主要用途是_________(填一项),C的化学式为______________。
(2)E中阳离子的结构示意图为__________
(3)向F中通入足量CO2生成K的离子方程式是________________________。
(4)J在工业上可用于净水,其原理是__________________ (用离子方程式表示)
【答案】制作铁红等 Al2O3 ![]() AlO2-+CO2+2H2O=Al(OH)3
AlO2-+CO2+2H2O=Al(OH)3 ![]() +HCO3- Fe3++3H2O
+HCO3- Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
【解析】
I为红褐色固体,应为Fe(OH)3,则H为Fe(OH)2,由转化关系可知G为FeCl2,D为Fe,J为FeCl3,B为Fe2O3,A和B的反应为铝热反应,A为Al,C为Al2O3,E为AlCl3,K为Al(OH)3,F为NaAlO2
(1)B为Fe2O3,B的主要用途是制作铁红等,C的化学式为Al2O3。
(2)E为AlCl3,阳离子为Al3+,离子的结构示意图为![]() ;
;
(3)向F中通入足量CO2生成K,即:向NaAlO2中通入足量CO2生成AlOH)3的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)J在工业上可用于净水,其原理是:铁盐可作絮凝剂,常用于净水,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,生成胶体,具有吸附性,可净化水。
Fe(OH)3+3H+,生成胶体,具有吸附性,可净化水。


科目:高中化学 来源: 题型:
【题目】(物质结构与性质)元素周期表中第57号元素镧到71号元素镥这15种元素统称为镧系元素。回答下列问题:
(1)钬(Ho)可用来制作磁性材料,其基态原子电子排布式为[Xe]4f116s2,钬(Ho)有___个未成对电子。
(2)钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),该材料所含元素中,电负性最大的元素是______(填元素符号),若YBa2Cu3O7-x材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=_____。
(3)下表是几种镧系元素的电离能(单位:kJ·mol-1)
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | |
Ce | 527 | 1047 | 1949 | 3547 |
La | 538 | 1067 | 1850 | 4819 |
Lu | 532 | 1340 | 2022 | 4370 |
Yb | 604 | 1174 | 2417 | 4203 |
据此,判断形成+3价化合物最稳定的元素是____(填元素符号)。
(4)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为____,1 mol CH2=CH2中含有的σ键数目为_______;常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。
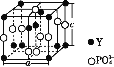
该磷钇矿的化学式为____,与PO43-互为等电子体的阴离子有____(写出两种离子的化学式)。已知晶胞参数a=0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则晶胞的密度为____g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )

A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____X=___
(2)A在5min末的浓度是___
(3)此时容器内的压强与开始时之比为:____。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。写出它的电子式______;
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___。Se2Cl2常用作分析试剂,其结构式为___。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应:![]() ,
,![]() ,向
,向![]() 、
、![]() 混合溶液中通入适量
混合溶液中通入适量![]() ,溶液中某些离子的物质的量变化如图所示。下列说法不正确的( )
,溶液中某些离子的物质的量变化如图所示。下列说法不正确的( )
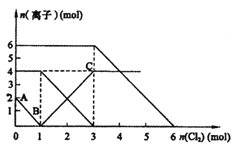
A.通过上述反应,比较还原性强弱![]()
B.原混合液中![]()
C.原混合液中![]()
D.通入![]() 时,溶液中发生的离子反应方程式为
时,溶液中发生的离子反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
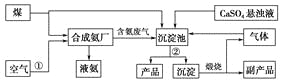
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,其中还原剂是___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_____________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____________(填“大于”或“小于”)生成物化学键形成放出的总能量。
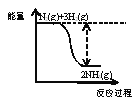
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
a.容器中N2、H2、NH3共存 b.N2、H2、NH3的物质的量之比为1:3:2
c.容器中的压强不随时间变化 d.N2、NH3浓度相等
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_________。
(4)下列各反应中,符合如图所示能量变化的是_____________(填序号)。
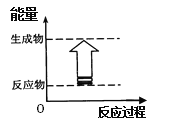
a.H2和Cl2的反应 b.Al和盐酸的反应 c.Na和H2O的反应 d.Ba(OH)2·8H2O和NH4C1的反应
(5)海水资源前景广阔。
①列举一种海水淡化的方法______________。
②采用空气吹出法从海水中提取溴的过程中,吸收剂SO2和溴蒸气反应生成氢溴酸以达到富集的目的,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,①5 g H2 ②11.2 L O2 ③2 mol H2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是_______,体积是_______;
(2)6.02×1023个CO2分子的物质的量是_____,质量是______;
(3)所含分子数最多的是______(请用序号回答,后同);
(4)所含原子数最多的是______;
(5)质量最大的是_______;
(6)体积最大的是_______;
(7) 体积最小的是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com