
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
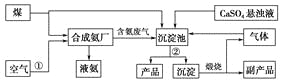
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
【答案】蒸馏 过滤 N2+3H2![]() 2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH4++SO42- 用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法) CaO CO2
2NH3 CaSO4+CO2+2NH3+H2O===CaCO3↓+2NH4++SO42- 用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3(或其他可行的方法) CaO CO2
【解析】
煤和水蒸气反应生成氢气和一氧化碳,利用空气中氮气和氢气在高温高压催化剂作用下反应生成氨气,煤燃烧生成的二氧化碳和生成的氨气和硫酸钙一起进入沉淀池中发生反应,生成碳酸钙沉淀和产品硫酸铵,碳酸钙煅烧得到副产品氧化钙,生成的二氧化碳进入沉淀池循环使用。
(1)合成氨原料之一氮气来源于空气,分离方法是将空气液化后蒸发分离出O2获得N2,所以操作①为液化;将沉淀池中的混合物经过滤可得到产品和沉淀,则操作②为过滤。因此,本题正确答案是:液化;过滤;
(2)工业上利用氮气和氢气在高温高压催化剂的条件下合成氨气,此反应的化学方程式为: N2+3H2![]() 2NH3 ,因此,本题正确答案是:N2+3H2
2NH3 ,因此,本题正确答案是:N2+3H2![]() 2NH3 。
2NH3 。
(3)产品是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3, CaSO4悬浊液在离子方程中要写分子式,反应化学方程式为: CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,改写成离子方程式为: CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH4++SO42-;
因此,本题正确答案是: CaSO4+CO2+2NH3+H2O=CaCO3↓+2NH4++SO42- ;
(4) 检验NH3的方法是:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3存在;因此,本题正确答案是:用湿润的红色石蕊试纸放在管口处,若试纸变蓝,证明废气中有NH3;
(5) 因为CaCO3煅烧可生成CO2和CaO,其中CO2可循环使用,所以CaO为副产品,因此,本题正确答案是:CaO;CO2。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A. NA的单位是摩尔
B. 标准状况下,22.4 L氦气所含的原子数为2NA
C. 1.7 g H2O2中含有的电子数为0.9 NA
D. 1 mol·L-1 NaCl溶液含有NA个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1molH2SO4的质量为98g·mol-1 B. H2SO4的摩尔质量为98g
C. 1molO2体积是22.4L D. 1molO2约有6.02×1023个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C.已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A. v(A)=0.5 mol·L-1·min-1
B. v(B)=1.2 mol·L-1·s-1
C. v(D)=0.4 mol·L-1·min-1
D. v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池能量转化的主要形式是____________________________________________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为________________________________________________________________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②金属锂吸收的氢气与放出的氢气的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是
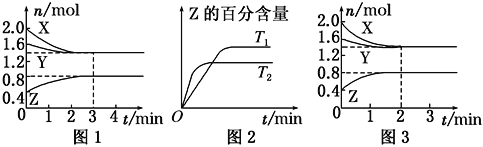
A. 容器中发生的反应可表示为3X(g)+Y(g) ==2Z(g)
B. 反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D. 保持其他条件不变,升高温度,反应的化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com