
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
| A.①=②=③=④ | B.①>③>②>④ |
| C.④=②>③=① | D.①=③>②=④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2Q | B.0.1Q | C.5Q | D.10Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.1×10 mol/L mol/L | B.1×10 mol/L mol/L | C.1×10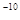 mol/L mol/L | D.1×10 mol/L mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 液面处的读数是a,则滴定管中剩余液体的体积是______mL
液面处的读数是a,则滴定管中剩余液体的体积是______mL 各待盛溶液润洗。
各待盛溶液润洗。| 滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
 ① ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.1.0mol/Lna2CO3溶液:c(OH一)=c(H+)+c(H2CO3)+c(HCO3-) |
| B.pH=6的纯水:c(H+)>c(OH一) |
C. 物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+): 物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+): c(NH4)2SO4>c(NH4HSO4)>c(NH4C1)  |
D.向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液: c(Na+)>c(CH3COO一)>c(H+)>c(OH一) c(Na+)>c(CH3COO一)>c(H+)>c(OH一) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com