
| A.①=②=③=④ | B.①>③>②>④ |
| C.④=②>③=① | D.①=③>②=④ |
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C.2011年9月29日成功发射的“天宫一号”目标飞行器使用了大量的复合材料 |
| D.合成高分子材料的广泛应用是有百利而无一害 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.x为弱酸,Vx < Vy | B.x为强酸,Vx > Vy |
| C.y为弱酸,Vx < Vy | D.y为强酸,Vx > Vy |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱过量,没有全部参加反应 | B.等浓度的一元强酸和一元弱碱溶液反应 |
| C.等浓度的一元弱酸和一元强碱混合 | D.浓的弱酸和稀的强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
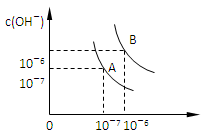
 比为_________。
比为_________。 D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com