
【题目】已知某可逆反应在密闭容器中进行:A(g)+2B(g)3C(g) ΔH>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )
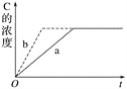
A.恒温恒容条件下将A、B的浓度增加一倍
B.恒温条件下加压(缩小容器体积)
C.使用合适的催化剂
D.升高温度
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
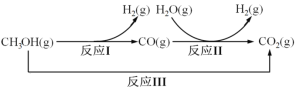
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
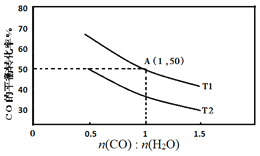
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
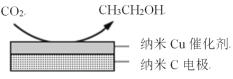
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
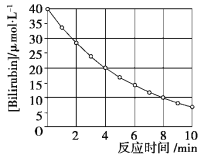
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
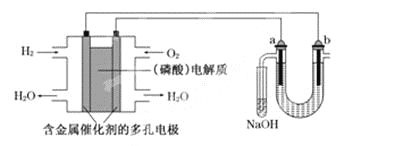
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
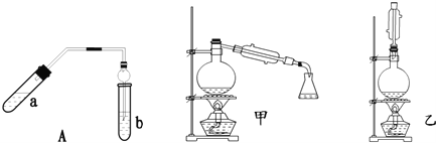
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4在一定条件下合成乙酸:CO2+CH4 ![]() CH3COOH。完成下列填空:
CH3COOH。完成下列填空:
(1)写出碳原子最外电子层的轨道表示式___________________________。
(2)钛(Ti)是22号元素,它是________________(选填编号)。
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CO2分子的电子式为__________________;其熔沸点比CS2低,原因是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com