
分析 加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量,进而求得Na2SO4的质量.
解答 解:加热发生反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少:4.16g-3.54g=0.62g,
设混合物中有NaHCO3的质量为x,新生成的Na2CO3的质量为y,
2NaHCO3=Na2CO3+CO2↑+H2O△m
168g 106g 62g
x y 0.62g
解得x=$\frac{168g×0.62g}{62g}$=1.68g,y=$\frac{106g×0.62g}{62g}$=1.06g,
所以原混合物中NaHCO3的质量是为1.68g;
设加热后碳酸钠的总质量是m,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
m 0.88g
m=$\frac{106×0.88g}{44}$=2.12g,
故原混合物中碳酸钠的质量:2.12g-1.06g=1.06g,硫酸钠的质量为:4.16g-1.68g-1.06g=1.42g,
答:Na2CO3为1.06 g,NaHCO3为1.68 g,Na2SO4为1.42 g.
点评 本题考查学生化学方程式的有关计算知识,题目难度中等,掌握碳酸钠、碳酸氢钠的化学性质为解答本题的关键,注意差量法在化学计算中的应用方法.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | KW随浓度的改变而改变 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间生成 n mol 的 A2,同时生成 n mol 的 AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间生成2n mol 的 AB,同时生成n mol 的 B2 | |
| D. | 单位时间生成n mol 的 A2,同时生成n mol 的 B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol H2 | B. | 8.8g CO2 | ||
| C. | 6.02×1022个CH4 | D. | 4.48L NH3(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
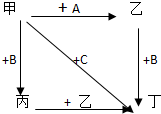 图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:
图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
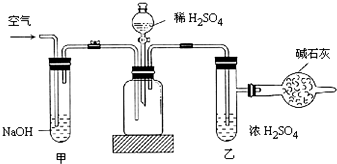
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
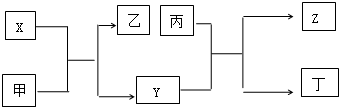
| A. | X为第三周期Π族元素,Y和Z位于不同主族 | |
| B. | 甲、乙、丙均能与水发生化合反应 | |
| C. | 晶体甲、乙、丙分别分子晶体、离子晶体和原子晶体 | |
| D. | X可用于制焰火烟花,丙可用于作太阳能电池的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的粒子一定含共价键 | |
| B. | 非金属元素组成的化合物一定不是离子化合物 | |
| C. | 第ⅠA族和第ⅦA族原子化合时一定形成离子键 | |
| D. | 共价化合物中一定不含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com