
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ�������
�¶�/�� | 25 | t1 | t2 |
ˮ�����ӻ����� | 1��10��14 | a | 1��10��12 |
�Իش��������⣺
(1)��25<t1<t2����Kw________1��10��14(����>������<����������)�������жϵ�������___________________��
(2)t2��ʱ����pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L���(���Ϻ���Һ�����Ϊԭ����Һ���֮��)�����û����Һ��pH=2����V1��V2=________������Һ�и������ӵ�Ũ���ɴ�С��˳����________��
���𰸡�> �¶����ߣ�ˮ�ĵ���̶���������ˮ�����ӻ��������� 9��11 c(Na+)>c(SO42-)>c(H+)>c(OH-)
��������
(1)ˮ��������ʣ�����������������������¶ȶԻ�ѧƽ���ƶ���Ӱ�������
(2)���¶���ˮ�����ӻ�ΪKw=1��10-12����ͼ��ϣ������û��Һ��pH=2���������������c(H+)=![]() ���㣬��ʽ����pH���ɼ�������ȡ�
���㣬��ʽ����pH���ɼ�������ȡ�
(1)ˮ��һ�ּ����ĵ���ʣ����ڵ���ƽ��H2O![]() H++OH-�������¶ȣ��ٽ�ˮ�ĵ��룬ʹˮ�ĵ���ƽ�������ƶ���ˮ���������c(H+)��c(OH-)����������ˮ�����ӻ�Kw= c(H+)��c(OH-)Ҳ��������Kw>1��10��14��
H++OH-�������¶ȣ��ٽ�ˮ�ĵ��룬ʹˮ�ĵ���ƽ�������ƶ���ˮ���������c(H+)��c(OH-)����������ˮ�����ӻ�Kw= c(H+)��c(OH-)Ҳ��������Kw>1��10��14��
(2)���¶���ˮ�����ӻ�ΪKw=1��10-12����pH=11�Ŀ�����������������Ũ��Ϊ��c(OH-)=0.1mol/L��pH=1��ϡ������������Ũ��Ϊ0.1mol/L��pH=2����Һ��������Ũ��Ϊ0.01mol/L������Һ�����㣺0.1mol/L��V2-0.1mol/L��V1=0.01mol/L��(V1+V2)��
�����ɵã�V1��V2=9��11��
pH=11��NaOH��Һ�����ʵ���Ũ��Ϊ0.1mol/L�������Ϊ9L����ӦNaOH�����ʵ���Ϊ0.9mol����Һ��������Ϊ0.9mol��
pH=1��������Һ��Ũ��Ϊ0.05mol/L�������Ϊ11L����Ӧ����Һ������������ʵ���Ϊ0.55mol��
���ڷ�Ӧ����Һ��pH=2����Ӧ������Һ��c(H+)=0.01mol/L����Ӧ������Һ�����Ϊ20L����n(H+)=0.2mol��������Һ�����ԣ���Һ�е������������ʵ�����С����ͬһ��Һ�У���Һ�������ͬ��������Һ���������ʵ���Խ�࣬����c=![]() ��֪������Ũ�Ⱦ�Խ����˸���Һ�е�����Ũ�ȴ�С��ϵΪ��c(Na+)>c(SO42-)>c(H+)>c(OH-)��
��֪������Ũ�Ⱦ�Խ����˸���Һ�е�����Ũ�ȴ�С��ϵΪ��c(Na+)>c(SO42-)>c(H+)>c(OH-)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����İ�������粒�������ij�ݻ��㶨����������У�������Ӧ��H2NCOONH4(s)![]() 2NH3(g)��CO2(g)���ڲ�ͬ�¶��£��÷�Ӧ��ƽ��״̬ʱ�IJ������������ʾ������˵����ȷ���ǣ� ��
2NH3(g)��CO2(g)���ڲ�ͬ�¶��£��÷�Ӧ��ƽ��״̬ʱ�IJ������������ʾ������˵����ȷ���ǣ� ��
�¶� | ƽ��Ũ��(mol��L��1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.��T2��T1����÷�Ӧ����H��0
B.���������N2��H2NCOONH4��������
C.NH3�����������ʱ��˵���÷�Ӧ�ﵽƽ��
D.T1��T2ʱ��ת����H2NCOONH4�����ʵ�����n(T2)��2��n(T1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С��ͬѧ̽��NH3��Cl2�ķ�Ӧ��װ����ͼ��ʾ�����³�ѹ�£��������ռ��ڱ�Ĥ���ʴ�(����)�У������ռ��ڷ�Ӧ���У��ر�K����ͼ���Ӻ�װ�ã�������ѹ�뷴Ӧ�ܣ���ַ�Ӧ���K������˵���������

A.��Ӧ��ʼ���ʴ������뷴Ӧ��
B.��Ӧ�����У���Ӧ���в�������
C.��K��ˮ�ᵹ���뷴Ӧ��
D.������Ӧԭ�������ڼ������������Ĺܵ��Ƿ�й©
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���ȷ���ǣ� ��
A.�����ȼ����Ϊ890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O(g) ��H=-890.3kJ��mol-1
B.500�桢30MPa�£��� 0.5molN2��g����1.5molH2��g�������ܱ������г�ַ�Ӧ���� NH3��g������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��![]() 2NH3��g�� ��H = -38.6kJ��mol-1
2NH3��g�� ��H = -38.6kJ��mol-1
C.HCl �� NaOH ��Ӧ���к�����H=-57.3 kJ��mol-1 ����H2SO4��Ba��OH��2��Ӧ���к��� ��H = 2����-57.3��kJ��mol -1
D.��101kPa ʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)=2H2O(1) ��H =-571.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���е�ԭ������������Ӧ����
ѡ�� | ���� | ԭ������ |
A | ��H2O2�м���MnO2���ܼ���H2O2�ķֽ����� | MnO2�����˷�Ӧ����Ļ�� |
B | ���ܱ��������з�Ӧ��A+xB��g�� | A�����塢x��1 |
C | ��ʢ��NO2������ܱ�������������ˮ�У�������������ɫ���� | 2NO2��g�� |
D | ��5mL 0.005mol��L-1 FeCl3��Һ�м���5mL 0.015mol��L-1 KSCN��Һ����Һ�ʺ�ɫ���ٵμӼ���1 mol��L-1 KSCN��Һ����Һ��ɫ���� | ����Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�����ϩ��![]() ������������ԭ�ӹ�ƽ��
������������ԭ�ӹ�ƽ��
B.ͬ����Ԫ�غ������������˵���������Ӷ�����
C.������������ˮ������������۵�ϸߣ���Ҫԭ��������й�
D.NO![]() ��������ԭ���ϵŵ��Ӷ�����0�����幹��Ϊƽ��������
��������ԭ���ϵŵ��Ӷ�����0�����幹��Ϊƽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CH3COOOH)�dz��õ���������������ˮ���ӷ�������������ֽ⡣�Ʊ�ԭ��Ϊ��H2O2+CH3COOH![]() CH3COOOH+H2O ��H<0���ƵõĹ�������(������H2O2)�����ⶨ�������£�����˵������ȷ����( )
CH3COOOH+H2O ��H<0���ƵõĹ�������(������H2O2)�����ⶨ�������£�����˵������ȷ����( )
![]()
A.Ӧ���ܱա����¡��ܹ������±����������
B.�ڳ�ѹ�����²��������������������������
C.��Һ����ɫ��Ϊdz��ɫ��30s�ڲ���ɫ��˵��H2O2�ѳ���
D.�ӹ�������������ҺĿ���ǻ�ԭCH3COOOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѹ���ʻ�������������ԭ��Ϊ��Ni(s)+4CO(g)![]() Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��10-5����֪��Ni(CO)4�ķе�Ϊ42.2�棬�������ʲ����뷴Ӧ��
Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��10-5����֪��Ni(CO)4�ķе�Ϊ42.2�棬�������ʲ����뷴Ӧ��
��һ�Σ���������CO��Ӧת������̬Ni(CO)4��
�ڶ��Σ�����һ�η�Ӧ���������������������230���Ƶøߴ����������ж���ȷ���ǣ� ��
A.�����¶ȣ��÷�Ӧ��ƽ�ⳣ����С
B.�÷�Ӧ�ﵽƽ��ʱ��v����[Ni(CO)4]=4v����(CO)
C.��һ�Σ���30���50������֮��ѡ��Ӧ�¶ȣ�ѡ50��
D.�ڶ��Σ�Ni(CO)4�ֽ��ʽϵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�����õ絼��(�絼��Խ��������Խǿ)��������pH������̽��NaHCO3��CaCl2�ܷ�����ѧ��Ӧ����25.00mL0.1mol��L-1NaHCO3��Һ�е�����������Ũ��CaCl2��Һ���絼���Լ�pH�仯������ͼ��ʾ������˵��������ǣ� ��
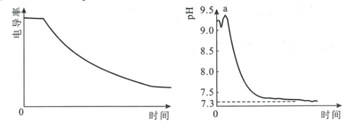
A.�絼���½���ԭ����������CaCO3����������Һ������Ũ�Ƚ���
B.a���pH�½���ԭ����Ca2+�ٽ�HCO3![]() H++CO
H++CO![]() ƽ������
ƽ������
C.pH=7.3ʱ����Һ��������ҪΪNaCl��CaCl2
D.����0.1mol��L-1CaCl2��Һ����Ũ�Ⱦ�Ϊ0.1mol��L-1��NaHCO3��Na2CO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com