
| A. | 化学实验室中的蔗糖纯度很高,可用来食用 | |
| B. | 实验室中制取完有毒气体,开窗通风即可 | |
| C. | 为了节约用水,实验室中用过的废洗液,可以用来冲洗厕所 | |
| D. | 不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道 |
分析 A、化学试剂不能食用;
B、有毒气体会对空气造成污染;
C、实验室中的废液,可能含有对地下水有污染的物质;
D、在化学实验的过程中,要保护自身的安全.
解答 解:A、化学试剂不能直接用鼻子闻,不能品尝和食用,故A错误;
B、有毒气体会对空气造成污染,应进行尾气处理,故B错误;
C、实验室中的废液,可能含有对地下水有污染的物质,如酸或碱或重金属离子等,故不能直接排放或冲洗厕所,故C错误;
D、在化学实验的过程中,要保护自身的安全,故不能直接用手接触药品,不能直接去闻药品的味道,不能品尝药品,故D正确.
故选D.
点评 本题考查了实验过程中的安全问题,难度不大,应注意的是有毒气体的尾气处理问题.


科目:高中化学 来源: 题型:实验题
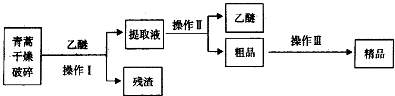
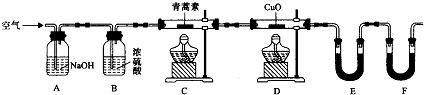
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠溶解在AlCl3溶液中:2Na+2H2O=2Na++H2↑ | |
| B. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | MgO溶于醋酸中:MgO+2H+=H2O+Mg2+ | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
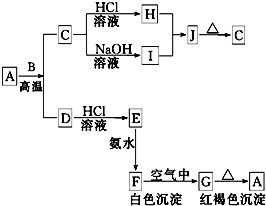 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
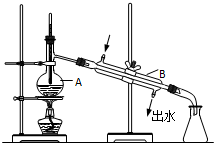 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解,过滤 | B. | 溶解,蒸发浓缩,冷却结晶,过滤 | ||
| C. | 溶解,蒸发结晶 | D. | 溶解,萃取,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com