
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
分析 A.标准状况下,戊烷是液体;
B.依据n=$\frac{m}{M}$计算物质的量结合乙烯分子结构计算共用电子对数;
C.苯不含碳碳双键;
D.聚乙烯的最简式为CH2,根据n=$\frac{m}{M}$计算最简式CH2的物质的量,结合N=nNA计算含有碳原子数.
解答 解:A.标准状况下,戊烷是液体,不能带入n=$\frac{V}{{V}_{m}}$计算其物质的量,故A错误;
B.28g乙烯物质的量为$\frac{28g}{28g/mol}$=1mol,一个乙烯分子含有6个共用电子对,因此共用电子对数目为6×6.02×1023mol-1,故B错误;
C.苯中碳原子之间的化学键是介于单键和双键之间的一种特殊的键,不含碳碳双键,故C错误;
D.最简式CH2的物质的量为$\frac{2.8g}{14g/mol}$=0.2mol,2.8g[CH2-CH2]n中含有的碳原子数为0.2mol×1×6.02×1023mol-1=0.2×6.02×1023,故D正确;
故选D.
点评 本题考查常用化学计量的有关计算,难度不大,注意n=$\frac{V}{{V}_{m}}$的使用条件和苯分子的结构.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为3.0g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | \ |
| ⑥摇匀、装瓶、贴上标签 | \ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 杂质 | 除杂试剂或方法 |
| (1)FeCl3溶液 | FeCl2 | |
| (2)FeCl2溶液 | FeCl3 | |
| (3)FeSO4溶液 | CuSO4 | |
| (4)Na2CO3 | NaHCO3 | |
| (5)Mg (OH)2 | Al(OH)3 | , |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
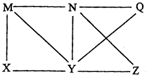 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )| A. | X可能为Al或Cl2 | B. | Y一定为NaOH(aq) | ||
| C. | N一定是HCl(aq) | D. | Q、Z中的一种必定为Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与乙炔 | B. | 丙烷与乙炔 | C. | 丙烯与丁烯 | D. | 乙烷与丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 转移溶液时不慎有少量洒到容量瓶外面 | |
| C. | 容量瓶不干燥,含有少量蒸馏水 | |
| D. | 定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
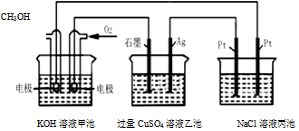
| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com