
【题目】工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:

已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式__________________________。步骤①中加入足量铁屑的目的是______________。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。
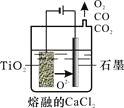
(3)步骤②的离子方程式是____________________________,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是_____________________。
(5)乳酸可由乙烯经下列步骤合成:
![]()
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯________m3。
【答案】TiO2++3H2O![]() H4TiO4+2H+ 将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解 TiO2+4e-=Ti+2O2- Fe2++2HCO3-=FeCO3↓+CO2↑+H2O (NH4)2SO4 防止Fe2+被空气中的氧气氧化 165.9
H4TiO4+2H+ 将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解 TiO2+4e-=Ti+2O2- Fe2++2HCO3-=FeCO3↓+CO2↑+H2O (NH4)2SO4 防止Fe2+被空气中的氧气氧化 165.9
【解析】
(1)根据水解原理:盐+水=酸+碱,则TiOSO4水解生成钛酸H4TiO4的离子方程式TiO2++3H2O![]() H4TiO4+2H+;加入足量铁屑能将溶液中的Fe3+还原为Fe2+,同时消耗溶液中的H+促进TiO2+水解;
H4TiO4+2H+;加入足量铁屑能将溶液中的Fe3+还原为Fe2+,同时消耗溶液中的H+促进TiO2+水解;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,故阴极电极反应:TiO2+4e-=Ti+2O2-;
(3)NH4HCO3在溶液中电离出HCO3-离子,易电离生成碳酸根,碳酸根和亚铁离子反应生成FeCO3促进HCO3-电离,故离子方程式Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;所得的副产物为溶液中没有参加反应的铵根离子和硫酸根离子形成的(NH4)2SO4;
(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化;
(5)由题意知,乳酸生成乳酸亚铁的物质的量之比为2:1,设需要乙烯x m3,则反应生成468kg乳酸亚铁晶体所需乙烯为![]() ×0.6×0.9=
×0.6×0.9=![]() ×2,解得x=165.9。
×2,解得x=165.9。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】对于化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);△H=a kJ/mol,下列叙述不正确的是( )

A. 反应过程中能量关系如上图表示,则该反应为放热反应
B. 若将该反应设计成原电池,锌为负极
C. 化学反应的焓变与反应方程式的计量数有关
D. 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:
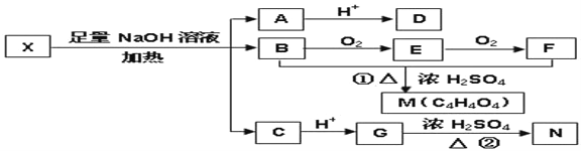
已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的![]() 的原子和价电子排布为4s24p5的原子
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
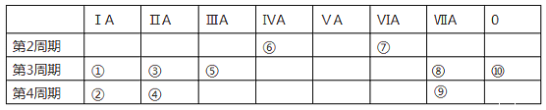
(1)10种元素中,第一电离能最大的是_______,电负性最小的金属元素是_____。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是__________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____________。
(4)①和⑨的最高价氧化物对应水化物的化学式分别为_________、____________
(5)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为______________________
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程:______________________________________
(7)⑨元素的价电子的轨道表示式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________________________。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为__________________
,其离子方程式为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
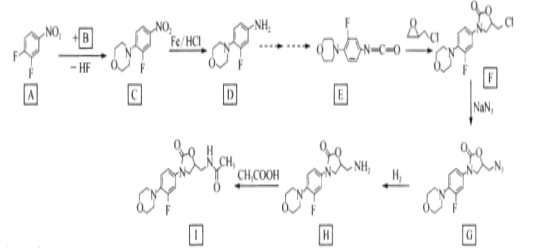
【题目】利奈唑胺(I)为细菌蛋白质合成抑制剂,其合成路线如下:
回答下列问题:
(1)A中的官能团名称是____,
(2)C—D、F—G的结反应类型分别为____
(3)B的结构简式为____。
(4)H—I的化学方程式为____。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出![]() 中的手性碳____
中的手性碳____
(6)芳香族化合物X是C的同分异构体,写出核磁共振氢谱有4组峰且峰面积比为4:4:2:1的X的结构简式____。(不考虑立体异构,只写一种)
(7)参照上述合成路线,设计以甲苯和乙酸为原料制备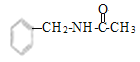 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com