
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
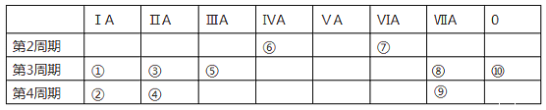
(1)10种元素中,第一电离能最大的是_______,电负性最小的金属元素是_____。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是__________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____________。
(4)①和⑨的最高价氧化物对应水化物的化学式分别为_________、____________
(5)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为______________________
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程:______________________________________
(7)⑨元素的价电子的轨道表示式为________________________________。
【答案】Ar K NaOH r(K+)>r(Ca2+)>r(Mg2+) NaOH HBrO4 Al(OH)3+OH- == AlO2-+2H2O ![]()
![]()
【解析】
根据元素在周期表中的位置,①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩元素分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar。
(1)Ar最外层有8个电子,结构稳定,10种元素中,第一电离能最大的是Ar;同周期元素从左到右电负性增大,同主族元素从上到下电负性减小,所以电负性最小的金属元素是K。
(2)同周期的元素从左到右,金属性减弱,金属性越强,最高价氧化物对应的水化物碱性越强,Na、Mg、Al三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH。
(3)微粒电子层数越多半径越大,电子层数相同时,质子数越多半径越小,所以K+、Mg2+、Ca2+三种离子,半径由大到小的顺序是r(K+)>r(Ca2+)>r(Mg2+)。
(4) Na的最高价为+1,最高价氧化物对应水化物的化学式为NaOH;Br的最高价是+7,最高价氧化物对应水化物的化学式为HBrO4;
(5) Na的最高价氧化物对应水化物是NaOH,Al的最高价氧化物对应水化物是Al(OH)3,NaOH、Al(OH)3相互反应生成偏铝酸钠,反应的离子方程式为Al(OH)3+OH- == AlO2-+2H2O;
(6) 第三周期元素中由电负性最小的元素是Na,电负性最大的元素是Cl,NaCl为离子化合物,用电子式表示NaCl的形成化合物的过程为![]()
(7)Br是35号元素,核外有35个电子,价电子排布式是4s24p5,价电子的轨道表示式为![]() 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】为了确定CH3COOH、![]() 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
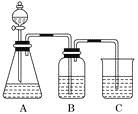
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________。
(2)装置B中盛放的试剂是________,它的作用是______________________。
(3)实验中观察到C中出现的主要现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用如图装置进行实验,试回答下列问题:
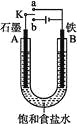
(1)若开始时开关K与a连接,则B极的电极反应为____________________________________。
(2)若开始时开关K与b连接,则B极的电极反应为______,总反应的离子方程式为________。有关上述实验,下列说法正确的是(填序号)___。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
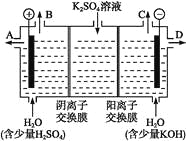
①该电解槽的阳极反应为______。
此时通过阴离子交换膜的离子数______(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因_______________。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:

已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式__________________________。步骤①中加入足量铁屑的目的是______________。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。
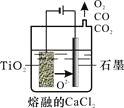
(3)步骤②的离子方程式是____________________________,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是_____________________。
(5)乳酸可由乙烯经下列步骤合成:
![]()
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料合成F,转化关系如下:

F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:①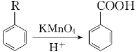 ;
;
②![]() (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)
③RCOCl![]() RCOR’
RCOR’
请回答下列问题:
(1)反应①为加成反应,写出A的化学式:_____________。
(2)B中所含官能团的名称为________;生成B时,常伴有副反应发生,反应所得产物除B外可能还含有____________________(写出一种产物的结构简式)。
(3)试剂①是_____________;试剂①和试剂②的顺序能否互换:________(填“能”或“不能”);为什么?_________________________________________________________。
(4)E生成F的化学方程式为__________________________________________________。
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示![]() 或
或![]() ]随pH的变化关系如图所示。下列说法不正确的是
]随pH的变化关系如图所示。下列说法不正确的是

A. 直线I中X表示的是![]()
B. 直线I、Ⅱ的斜率均为1
C. c(HC2O4-)>c(C2O42-)>c(H2C2O4)对应1.22<pH<4.19
D. c(Na+)=c(HC2O4-)+2c(C2O42-)对应pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com