
【题目】为了确定CH3COOH、![]() 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
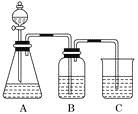
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________。
(2)装置B中盛放的试剂是________,它的作用是______________________。
(3)实验中观察到C中出现的主要现象是____________________________。
【答案】2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ 饱和NaHCO3溶液 除去CO2中可能混有的CH3COOH C中溶液变浑浊
【解析】
(1)苯酚的酸性比H2CO3的弱,故将CO2通入![]() 溶液中可制得苯酚,从而证明酸性H2CO3>
溶液中可制得苯酚,从而证明酸性H2CO3>![]() ,因此装置A的目的是制取CO2,锥形瓶中装有一种易溶于水的正盐固体,可为Na2CO3,分液漏斗中盛放的为CH3COOH,二者反应的离子方程式为2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑;
,因此装置A的目的是制取CO2,锥形瓶中装有一种易溶于水的正盐固体,可为Na2CO3,分液漏斗中盛放的为CH3COOH,二者反应的离子方程式为2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑;
(2)装置B中盛放的是饱和NaHCO3溶液,目的是除去CO2中混有的CH3COOH,防止醋酸与苯酚钠发生反应,对实验造成干扰;
(3)装置C的目的是证明碳酸酸性强于苯酚,因此是CO2通入苯酚钠中,生成苯酚,苯酚在水中的溶解度低,会析出,因此溶液变浑浊。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下pH为2的醋酸溶液中由H2O电离出的H+数为10-12NA
B.标准状况下,28gCO与22.4LSO3所含分子数都为NA
C.50mL8mol/L的浓盐酸与足量的MnO2加热反应,生成Cl2的分子数为0.1NA
D.在反应S+2KNO3+3C![]() K2S+N2↑+3CO2↑中,每生成2NA个气体分子,参加反应的氧化剂的物质的量为1.5mol
K2S+N2↑+3CO2↑中,每生成2NA个气体分子,参加反应的氧化剂的物质的量为1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)乙醇易溶于水,是因为乙醇分子间存在氢键。________
(2)HO—CH2CH2—OH也可与Na反应,断裂C—O键。________
(3)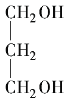 的命名是1,3二丙醇。________
的命名是1,3二丙醇。________
(4)1丙醇在氢氧化钠溶液中加热也可发生消去反应。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA
B. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
C. 7.8g ![]() 中含有的碳碳双键数为0.3NA
中含有的碳碳双键数为0.3NA
D. 标准状况下,11.2L的戊烷所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);△H=a kJ/mol,下列叙述不正确的是( )

A. 反应过程中能量关系如上图表示,则该反应为放热反应
B. 若将该反应设计成原电池,锌为负极
C. 化学反应的焓变与反应方程式的计量数有关
D. 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柳胺酚是一种药物,其常用的合成路线如图所示。回答下列问题:

已知:![]()
(1)柳胺酚的化学式为___________________。
(2)A→B反应所需的试剂是____________;B→C反应的化学方程式为_____________。
(3)D→E反应的有机反应类型是____________________;物质E中含有的官能团的名称是____________________________________。
(4)E和F反应的化学方程式为____________。
(5)写出同时符合下列条件的F的同分异构体的结构简式:_____________________。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2mol NaOH溶液发生反应;
④苯环上有2种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如图反应得到,则丙的结构不可能是
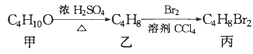
A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
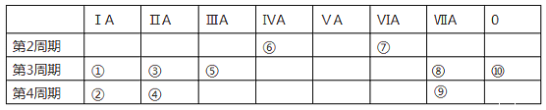
(1)10种元素中,第一电离能最大的是_______,电负性最小的金属元素是_____。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是__________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____________。
(4)①和⑨的最高价氧化物对应水化物的化学式分别为_________、____________
(5)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为______________________
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程:______________________________________
(7)⑨元素的价电子的轨道表示式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com