
【题目】化合物丙可由如图反应得到,则丙的结构不可能是
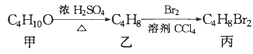
A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
【答案】A
【解析】
由转化关系可知,甲在浓硫酸、加热的条件下发生消去反应生成乙,甲为醇,乙为烯烃,烯烃与溴发生加成反应生成丙,丙中2个溴原子应分别连接在相邻的碳原子上,结合C4H8的烯烃同分异构体进行判断。
根据上述分析可知,
A. 分子中2个溴原子不是分别连接在相邻的碳原子上,不可能是烯烃与溴的加成产物,故A项错误;
B. 若乙为(CH3)2C=CH2,与溴发生加成反应生成(CH3)2CBrCH2Br,B项正确;
C.若乙为CH3CH2CH=CH2,与溴发生加成反应生成CH3CH2CHBrCH2Br,C项正确;
D.若乙为CH3CH=CHCH3,与溴发生加成反应生成CH3(CHBr)2CH3,D项正确;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸与乙醇的混合液加热后可产生乙烯。为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:将生成的气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。
乙同学在甲同学的实验中,发现褪色后的溶液中有硫酸根离子,推测在制得的乙烯中还可能有少量还原性气体杂质,由此他提出必须先除去,再与溴水反应。
请回答下列问题:
(1)甲同学实验中溴水褪色的主要的化学方程式为______________________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生加成反应,理由是________。
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙烯
d.使溴水褪色的物质就是乙烯
(3)乙同学推测乙烯中必定含有的一种气体是________,可以用________来验证,这种气体与溴水反应的化学方程式是_____________________________________________。
(4)为验证溴水褪色的反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性的方法,理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定CH3COOH、![]() 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
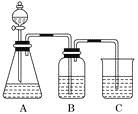
(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式为________________________________________________________________________。
(2)装置B中盛放的试剂是________,它的作用是______________________。
(3)实验中观察到C中出现的主要现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:ZnS与稀硫酸反应,且化合价不变;CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的___(填标号)。
A. B.
B.
C. D.
D.
(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:____。(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作____。
(4)写出第二次浸出的化学反应方程式___,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加____。
(5)滤渣2的主要成分是___。浓缩、结晶得到硫酸锌晶体的主要仪器名称是____。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
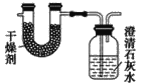
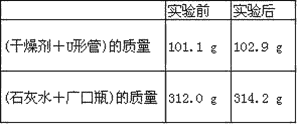
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为_____________g。
(2)生成的水中氢元素的质量为_______g。
(3)生成的二氧化碳中碳元素的质量为_______ g。
(4)该燃料中碳元素与氢元素的质量比为_______。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_______,结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com