
 已知:在常温下,浓度均为0.1mol?L-1的下列六种溶液的pH:
已知:在常温下,浓度均为0.1mol?L-1的下列六种溶液的pH:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
 ,故答案为:
,故答案为: .
.


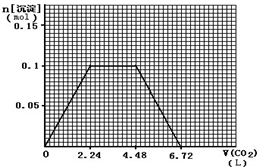
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:

 (Diels-Alder 反应)
(Diels-Alder 反应) 制备丁烯二酸酐
制备丁烯二酸酐 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、活泼的金属与盐酸反应,生成了1molH2 ,发生转移的电子数目为3NA |
| B、28g CO气体中所含有的电子数目为28NA |
| C、0℃、一个大气压下,NA 个氢气分子的体积约为22.4L |
| D、醋酸的摩尔质量与NA 个醋酸分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
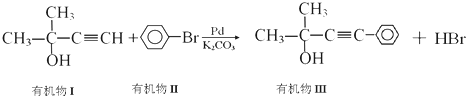
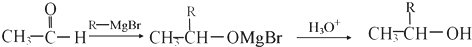
 有机物I
有机物I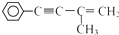 的反应条件是
的反应条件是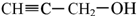 与CH3I能发生类似①的反应,该反应方程式是
与CH3I能发生类似①的反应,该反应方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 升高温度 | X的体积分数变大 |
| B | 增大压强 | 平衡向右移动 |
| C | 减小压强 | Y的体积分数不变 |
| D | 充入一定量Z | X的体积分数变大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
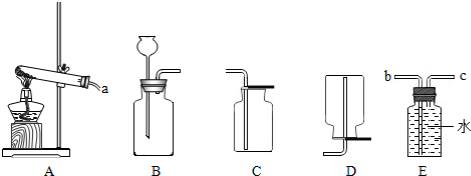
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| MaOH(aq) |
| △ |
| CO2 |
| 石灰乳 |
| 盐酸 |
| 蒸发灼烧 |
| NH3CO2 |
| △ |
| HCl(aq) |
| △ |
| 石灰乳 |
| 煅烧 |
| A、②④⑤ | B、②③④ |
| C、①③⑤ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com