
【题目】在反应A(g)+2B(g)![]() 3C(g)+4D(g)中,表示该反应速率最快的是
3C(g)+4D(g)中,表示该反应速率最快的是
A. v(A)=0.2mol/(L·s) B. v(B)=0.6mol/(L·s)
C. v(C)=0.8mol/(L·s) D. v(D)=10 mol/(L·min)
科目:高中化学 来源: 题型:
【题目】如图所示(乙装置中X为阳离子交换膜,甲醚的结构简式为CH3OCH3) 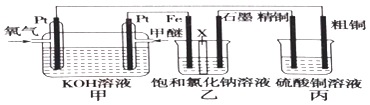
根据要求回答下列相关问题:
(1)写出负极的电极反应: .
(2)氢氧化钠主要在(填“铁极”或“石墨极”)区生成.
(3)如果粗铜中含有锌、银等杂质,则粗铜的电极反应为:、 .
(4)反应一段时间,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
(5)若在标准状况下有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 .
(6)若将丙装置改成在标准状况下,用石墨作电极电解体积为2L的CuSO4溶液,写出电解CuSO4溶液时的离子反应方程式;当电解适当时间后断开电源,发现只需补充22.2g固体Cu2(OH)2CO3即可使电解液恢复到原浓度与体积,则原CuSO4溶液的浓度是mol/L;若将丙设计成在镀件上镀铜的装置,该如何改动,请用简要的语言叙述: .
(7)若将乙中的交换膜去掉,发现只有H2逸出,则试写出乙池中发生的总反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是甲烷、乙烯、丙烯(CH3﹣CH═CH2)、苯中的一种; 甲、乙能使溴水褪色,甲分子中所有原子共平面,但乙分子不是所有原子共平面.
丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色.
丁既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应.一定条件下,1mol丁可以和3mol H2完全加成.
请根据以上叙述完成下列填空:
(1)甲的结构简式 , 丙的空间构型是 .
(2)丁与H2在催化剂作用下发生加成反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐. 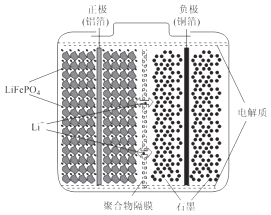
(1)电池工作时的总反应为:LiFePO4+6C ![]() Li1﹣xFePO4+LixC6 , 则放电时,正极的电极反应式为 . 充电时,Li+迁移方向为(填“由左向右”或“由右向左”),图中聚合物隔膜应为(填“阳”或“阴”)离子交换膜.
Li1﹣xFePO4+LixC6 , 则放电时,正极的电极反应式为 . 充电时,Li+迁移方向为(填“由左向右”或“由右向左”),图中聚合物隔膜应为(填“阳”或“阴”)离子交换膜.
(2)用该电池电解精炼铜.若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为(保留小数点后一位). (已知:法拉第常数F=96500C/mol,电流利用效率= ![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M( ![]() )
)
是牙科粘合剂, X是高分子金属离子螯合剂,以下是两种物质的合成路线:
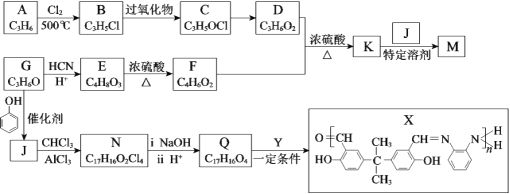
已知:R、R1、R2代表烃基或其他基团
![]()
![]()
![]()
(1)A为烯烃,B中所含官能团名称是______,A→B的反应类型是______。
(2)C→D的反应条件是______。
(3)E分子中有2个甲基和1个羧基,E→F的化学方程式是______。
(4)D+F→K的化学方程式是______。
(5)下列关于J的说法正确的是______。
a.可与Na2CO3溶液反应
b.1 mol J与饱和溴水反应消耗8 mol Br2
c.可发生氧化、消去和缩聚反应
(6)G分子中只有1种氢原子,G→J的化学方程式是______。
(7)N的结构简式是______。
(8)Q+Y→X的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:

(1)反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。则△H1________△H2(填“>”、“<”或“=”);△H3=________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:

①温度升高,K值________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值________ (填“增大”“减小”或“不变”),对生成乙醇________ (填“有利”或“不利”)
③在700K、氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。

①阴极的电极反应式为________________。
②从电解后溶液中分离出乙醇的操作方法为________________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________ (填序号)

①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为______。
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为______,如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式______________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式_______________________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是________________。

利用化学平衡移动原理分析低于或高于最优温度时,MoS3的产率均下降的原因:_______________________。
(5)MoO3·H2O作为高能非水体系电池的正极材料优于一般新型材料,某电池反应为: MoO3·H2O+xA=AxMoO3·H2O (某文献记载:式中0+为Li+、H+、K+、Na+等。A+的注入使得部分Mo6+还原为MO5+),写出该电池以金属锂为负极,充电时的阳极反应式:__________________。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8)钼酸钠晶体(NaMoO4·2H20)是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMo04开始沉淀时,溶液中的c(MoO42-)/c(SO42-)____(結果保留2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com