
����Ŀ����ͼ��ʾ����װ����XΪ�����ӽ���Ĥ�����ѵĽṹ��ʽΪCH3OCH3�� 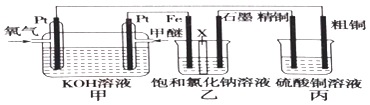
����Ҫ��ش�����������⣺
��1��д�������ĵ缫��Ӧ�� ��
��2������������Ҫ�������������ʯī�����������ɣ�
��3�������ͭ�к���п���������ʣ����ͭ�ĵ缫��ӦΪ���� ��
��4����Ӧһ��ʱ�䣬����ͭ��Һ��Ũ�Ƚ������������С�����䡱����
��5�����ڱ�״������2.24L�����μӷ�Ӧ����װ������������ͭ������Ϊ ��
��6��������װ�øij��ڱ�״���£���ʯī���缫������Ϊ2L��CuSO4��Һ��д�����CuSO4��Һʱ�����ӷ�Ӧ����ʽ��������ʵ�ʱ���Ͽ���Դ������ֻ�貹��22.2g����Cu2��OH��2CO3����ʹ���Һ�ָ���ԭŨ�����������ԭCuSO4��Һ��Ũ����mol/L����������Ƴ��ڶƼ��϶�ͭ��װ�ã�����θĶ������ü�Ҫ������������ ��
��7���������еĽ���Ĥȥ��������ֻ��H2�ݳ�������д���ҳ��з������ܷ�Ӧ�� ��
���𰸡�
��1��CH3OCH3��12e��+16OH���T2CO32��+11H2O
��2������
��3��Zn��2e��=Zn2+�� Cu��2e��=Cu2+
��4����С
��5��12.8g
��6��2Cu2++2H2O ![]() 2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ,��������ͭ�ijɶƼ�
2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ,��������ͭ�ijɶƼ�
��7��NaCl+H2O ![]() NaClO+H2��
NaClO+H2��
���������⣺��1����װ��Ϊȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ����������ϼ���ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OCH3��12e��+16OH���T2CO32��+11H2O��
�ʴ�Ϊ��CH3OCH3��12e��+16OH���T2CO32��+11H2O����2����װ��Ϊ����Ȼ���װ�ã����缫����ԭ��صĸ�����Ϊ���ص�������ʯīΪ�����������������ӷŵ����������������������ӷŵ磬����������������������Ũ�ȴ���������Ũ����Һ�ʼ��ԣ�������װ������������������Ҫ�����������ʴ�Ϊ����������3�������ͭ�к���п���������ʣ������ϲ���ͭ����п����ʧ���ӽ�����Һ������������ͭ���ӣ������缫����ʽ�ֱ�ΪZn��2e��=Zn2+��Cu��2e��=Cu2+���ʴ�Ϊ��Zn��2e��=Zn2+��Cu��2e��=Cu2+����4���ɣ�3�������缫����ʽ�ֱ�ΪZn��2e��=Zn2+��Cu��2e��=Cu2+������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С��
�ʴ�Ϊ����С����5�����ݴ��������ת�Ƶ�������ȵ�������ͭ�Ĺ�ϵʽΪ��O2��������2Cu��������ͭ��������x��
O2������������ | 2Cu |
22.4L | 128g |
2.24L | x |
x=12.8g��
�ʴ�Ϊ��12.8 g����6����ʯī���缫������Ϊ2L��CuSO4��Һ����ͭ�����������ᣬ���ӷ���ʽΪ��2Cu2++2H2O ![]() 2Cu+O2��+4H+������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol��������ԭ��ҺCuSO4��Ũ����
2Cu+O2��+4H+������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol��������ԭ��ҺCuSO4��Ũ���� ![]() =0.1molL��1����������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ������������Խ�������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ����ɣ��ʴ�Ϊ��2Cu2++2H2O
=0.1molL��1����������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ������������Խ�������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ����ɣ��ʴ�Ϊ��2Cu2++2H2O ![]() 2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ�����7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ܷ�ӦΪ��NaCl+H2O
2Cu+O2��+4H+��0.1����������ͭ�ijɴ�ͭ����������ͭ�ijɶƼ�����7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ܷ�ӦΪ��NaCl+H2O ![]() NaClO+H2�����ʴ�Ϊ��NaCl+H2O
NaClO+H2�����ʴ�Ϊ��NaCl+H2O ![]() NaClO+H2����
NaClO+H2����
��1����װ��Ϊȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�Ͷ��ȼ�ϵĵ缫�Ǹ�����������ȼ��ʧ���ӷ���������Ӧ����2����װ��Ϊ����Ȼ���װ�ã����缫����ԭ��صĸ�����Ϊ���ص�������ʯīΪ����������������������������3����װ��Ϊ����ͭװ�ã�������Zn��Cu��Ag��������п��ͭ����������4������ת�Ƶ��������֪���������ܽ��ͭС��������������ͭ�����Ա�װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ���С����5���ݴ��������ת�Ƶ�������ȵ�������ͭ�Ĺ�ϵʽΪ��O2����������2Cu���㣻��6����ʯī���缫������Ϊ2L��CuSO4��Һ����ͭ���������������22.2gA��Cu2��OH��2CO3�������ʵ���Ϊ0.1mol������ʹ���Һ�ָ�ԭŨ�������������ͭԪ���غ��֪��n[CuSO4]=0.2mol������c= ![]() ���㣻��������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ�����������7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ݴ���д��
���㣻��������Ƴ��ڶƼ��϶�ͭ��װ�ã���ͭ���������Ƽ�����������7���������еĽ���Ĥȥ��������ֻ��H2�ݳ��������ɵ��������������Ƽ�����Ӧ�����Ȼ��ƺʹ������ƣ��ݴ���д��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���ڻ�ѧ�仯���Ҳ����м������塢Һ�塢�������
A. ʯ�͵ķ���B. ʯ�͵��ѽ�
C. ú�ĸ���D. ú������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�в���Ҫ�ƻ���ѧ������
A.�����Ȼ��B.Na2CO3�ۻ�C.�ɱ�����D.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A. ����ͼװ�õ�⾫��þ
����ͼװ�õ�⾫��þ
B. ����ͼװ����֤�Թ�����˿�������ⸯʴ
����ͼװ����֤�Թ�����˿�������ⸯʴ
C. ��ͼװ����Mg��������Al������
��ͼװ����Mg��������Al������
D. ����ͼװ�öԶ��ε�ؽ��г��
����ͼװ�öԶ��ε�ؽ��г��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)��O2(g)![]() 2SO3(g)+Q���ǽӴ��������������Ҫ��Ӧ֮һ��
2SO3(g)+Q���ǽӴ��������������Ҫ��Ӧ֮һ��
���������գ�
��1�������������¶ȿ�����400�桫500����Ŀ����__________________________________���÷�Ӧ�����ѹ��ԭ����____________________________________________________��
��2��������Ӧ���ܱ������дﵽ��ѧƽ��״̬�ı�־Ϊ______________________________��
��3��������Ӧ��ƽ�ⳣ������ʽΪ__________________________________�������¶����ߣ�ƽ�ⳣ��__________________(ѡ���������С�����䡱����
��4���Ӵ�����������β���к���SO2�����Բ��ð�ˮ����������(NH4)2SO3��NH4HSO3�Ļ����Һ����Ӧ����(NH4)2SO3�ֿ��Խ�NO2ת��ΪN2��(NH4)2SO4��
�� д������NH4HSO3�Ļ�ѧ����ʽ__________________________________________��
�� ��дNO2��(NH4)2SO3��Ӧ�Ļ�ѧ����ʽ������÷�Ӧ�е���ת�Ƶķ������Ŀ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����������ģ�͡�����˵����ȷ����(����)
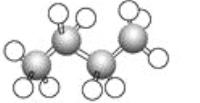
A. ������ķ���ʽΪC4H8
B. ������4��̼ԭ����ͬһ��ֱ����
C. �������4��C��C����
D. �����й�����13�����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������廯����E �Ǻϳ�ij�����ϵ��м��壬�Ա�Ϊԭ�Ϻϳ�E��������:
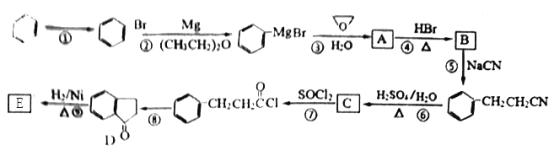
��֪��CH3Br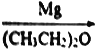 CH3MgBr
CH3MgBr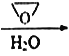 CH3CH2CH2OH
CH3CH2CH2OH
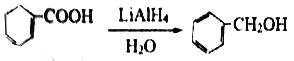
��1��д����Ӧ��������Լ�������_____________��
��2��������A��������________�������в�ͬ��ѧ��������ԭ�ӹ���_____�֣������̼ԭ����Ŀ�����_______����
��3��D�к��������ŵ�������________��
��4��д����Ӧ��Ļ�ѧ����ʽ________���÷�Ӧ�ķ�Ӧ������________ ��
��5��������C����Na2CO3��Һ��Ӧ����CO2������a��b������C��ͬ���칹���ж��֣����д����һ�(-CH2CH3),�ұ����ϵ�һ��ȡ����ֻ�����ֵ�ͬ���칹��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ___________��
a.���ڷ����廯���� b.�ܷ���������Ӧ��Ҳ�ܷ���ˮ�ⷴӦ
��6���ڷ�����д����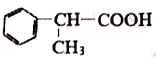 Ϊ��Ҫԭ�ϣ��ϳ�
Ϊ��Ҫԭ�ϣ��ϳ�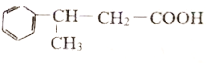 �����̡�
�����̡�
 ___________
___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����˷�����һ���л�����Ʒ�������ʽ��C63H140O85N11S2������Ʒ�ܿ�����
A. ������ B. ������ C. ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�ӦA(g)+2B(g)![]() 3C(g)+4D(g)�У���ʾ�÷�Ӧ����������
3C(g)+4D(g)�У���ʾ�÷�Ӧ����������
A. v(A)=0.2mol/(L��s) B. v(B)=0.6mol/(L��s)
C. v(C)=0.8mol/(L��s) D. v(D)=10 mol/(L��min)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com