
【题目】下列说法正确的是( )
A. 用如图装置电解精炼镁
用如图装置电解精炼镁
B. 用如图装置验证试管中铁丝发生析氢腐蚀
用如图装置验证试管中铁丝发生析氢腐蚀
C. 如图装置中Mg作负极,Al作正极
如图装置中Mg作负极,Al作正极
D.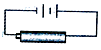 用如图装置对二次电池进行充电
用如图装置对二次电池进行充电
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用电解原理将NO转化为NH4NO3,既节约了资源,又保护了环境。下列有关说法正确的是
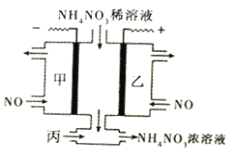
A. NO转化为NH4NO3的反应属于氮的固定
B. 阴极上发生还原反应,电极反应式为:NO+5H++5e-==NH3·H2O
C. 电解池两极上分别生成的甲是NH4+,乙是NO3-
D. 为使电解产物全部转化为NH4NO3,需补充的物质丙为HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( ) 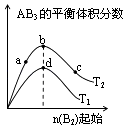
A.图中T2一定大于T1
B.图中b点速率一定大于d点速率
C.达到平衡时,A2的转化率大小为:c>b>a
D.加入催化剂可以使状态d变为状态b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装人含酚酞的0.01mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.则下列叙述正确的是( ) 
A.①说明水解反应为放热反应
B.③说明水解反应为吸热反应
C.①中溶液红色变浅
D.③中溶液红色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2Al+Fe2O3![]() Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
(1)氧元素在元素周期表中的位置为_______________,其离子结构示意图为__________。
(2)铝盐常用作净水剂,用文字和化学用语进行解释_______________________________。
(3)氧的非金属性强于氮,用元素周期律知识分析原因_____________________________。
(4)Al2O3与NaOH溶液反应的离子方程式为______________________________________。
II.NH4Al(SO4)2·12H2O水溶液呈_____性(选填“酸”、“碱”或“中”),比较溶液中离子浓度大小c(NH4+)_____c(Al3+)(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(乙装置中X为阳离子交换膜,甲醚的结构简式为CH3OCH3) 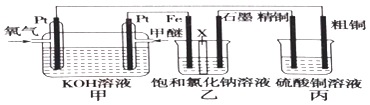
根据要求回答下列相关问题:
(1)写出负极的电极反应: .
(2)氢氧化钠主要在(填“铁极”或“石墨极”)区生成.
(3)如果粗铜中含有锌、银等杂质,则粗铜的电极反应为:、 .
(4)反应一段时间,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
(5)若在标准状况下有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 .
(6)若将丙装置改成在标准状况下,用石墨作电极电解体积为2L的CuSO4溶液,写出电解CuSO4溶液时的离子反应方程式;当电解适当时间后断开电源,发现只需补充22.2g固体Cu2(OH)2CO3即可使电解液恢复到原浓度与体积,则原CuSO4溶液的浓度是mol/L;若将丙设计成在镀件上镀铜的装置,该如何改动,请用简要的语言叙述: .
(7)若将乙中的交换膜去掉,发现只有H2逸出,则试写出乙池中发生的总反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素和化合物的叙述正确的是
A. 组成细胞的元素大多以无机盐的形式存在
B. 单糖是不能水解的糖
C. 细胞中包括糖类、脂肪、蛋白质、核酸在内的有机物都能为细胞生命活动提供能量
D. 胰岛素、蛋白质、脂肪的合成过程中需要供给氮源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐. 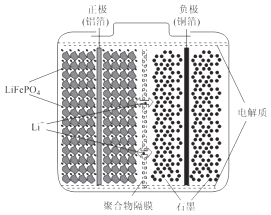
(1)电池工作时的总反应为:LiFePO4+6C ![]() Li1﹣xFePO4+LixC6 , 则放电时,正极的电极反应式为 . 充电时,Li+迁移方向为(填“由左向右”或“由右向左”),图中聚合物隔膜应为(填“阳”或“阴”)离子交换膜.
Li1﹣xFePO4+LixC6 , 则放电时,正极的电极反应式为 . 充电时,Li+迁移方向为(填“由左向右”或“由右向左”),图中聚合物隔膜应为(填“阳”或“阴”)离子交换膜.
(2)用该电池电解精炼铜.若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为(保留小数点后一位). (已知:法拉第常数F=96500C/mol,电流利用效率= ![]() ×100%)
×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com