
| A. | v(O2)=0.125mol•(L•s)-1 | B. | v(NO)=0.01mol•(L•s)-1 | ||
| C. | v(NH3)=0.01 mol•(L•s)-1 | D. | v(NH3)=0.2 mol•(L•s)-1 |
分析 根据化学反应速率的定义和化学反应速率之比等化学计量数之比进行计算.
解答 解:4NH3+5O2???4NO+6H2O,v(NO)=$\frac{△c}{△t}$=$\frac{3mol/L}{30s}$=0.1 mol•(L•s)-1;
A.v(NO):v(O2)=4:5,故v(O2)=$\frac{5}{4}$v(NO)=0.125 mol•(L•s)-1,故A正确;
B.v(NO)=0.1 mol•(L•s)-1,故B错误;
C.v(NO):v(NH3)=1:1,故v(NH3)=v(NO)=0.1 mol•(L•s)-1,故C错误;
D.v(NH3)=0.1 mol•(L•s)-1,故D错误;
故选A.
点评 本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | C+H2O═CO+H2 | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加H2O | B. | 加入饱和食盐水 | ||
| C. | 增大压强 | D. | 升高温度(不考虑盐酸挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:向稀的AgNO3溶液中逐滴加入稀氨水至刚好生成沉淀 | |
| B. | 除去苯中的少量苯酚:加入浓溴水然后过滤 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入饱和碳酸钠溶液,充分振荡,静置分液,弃水层 | |
| D. | 检验溴乙烷中的溴:将溴乙烷与NaOH溶液共热后冷却,再滴加AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

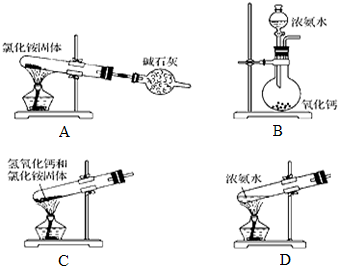
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol•L-1的溶液 | |
| B. | 用硫粉覆盖地下撒有的汞;用热碱溶液洗去试管内壁的硫;用二氧化碳扑灭金属钠引起的失火;用湿润的红色石蕊试纸检验氨气是否集满;以上操作均合理 | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
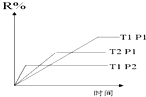
| A. | 正反应吸热,L是气体 | B. | 正反应吸热,L是固体 | ||
| C. | 正反应放热,L是气体 | D. | 正反应放热,L是固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com