
| A.5mL | B.10mL | C.25mL | D.50mL |

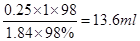 。
。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热条件下,蒸发得到NaOH晶体 |
B.加热蒸发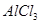 饱和溶液得纯净的 饱和溶液得纯净的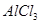 晶体 晶体 |
C.向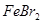 溶液中加入过量的氯水,加热蒸发得 溶液中加入过量的氯水,加热蒸发得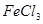 晶体 晶体 |
D.向Fe2(SO4)3溶液加入足量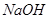 溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得 溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得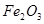 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
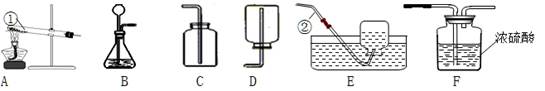
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

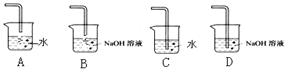
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
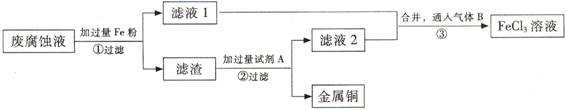 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

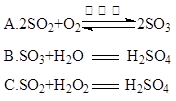
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
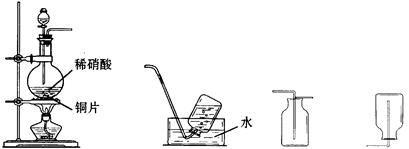
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com