
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:实验题
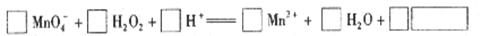

 氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | | |
| 验证不稳定性 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2 | B.HF | C.OF2 | D.O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
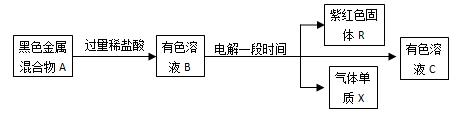
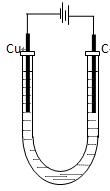
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
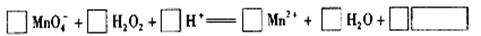
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.(NH4)2SO3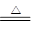 2NH 2NH 3↑+H2O+SO2↑ 3↑+H2O+SO2↑ |
B.2CO+O2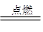 2CO2 2CO2 |
C.2C+SiO2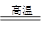 Si+2CO↑ Si+2CO↑ |
D.NH4NO3 N2O+ 2H2O N2O+ 2H2O |
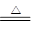 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.I->Fe2+>Cl->SO2 | B.SO2>I->Fe2+>Cl- |
| C.Fe2+>I->Cl->SO2 | D.Cl->Fe2+>SO2>I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com