
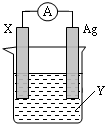
 依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:分析 根据反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”分析,在反应中,Zn被氧化,失电子,应为原电池的负极,电极反应为Zn-2e-=Zn2+,则正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,电解质溶液为AgNO3 ,结合电极方程式解答该题.
解答 解:(1)由反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”可知,在反应中,Zn被氧化,失电子,应为原电池的负极,电子从负极流出,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:流出;AgNO3;
(2)正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-=Ag,X为负极,发生氧化反应,反应式为:Zn-2e-=Zn2+;
故答案为:正; Ag++e-=Ag; Zn-2e-=Zn2+;
(3)因为反应速率之比等于系数之比,所以当Ag+的消耗速率为0.05mol/(L•min)时,Zn2+的生成速率是$\frac{1}{2}$×0.05mol/(L•min)=0.025mol/(L•min),
故答案为:0.025mol/(L•min).
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.


科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②③可以 | D. | ①③④可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸氢钠溶液中滴加氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| C. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HS03- | |
| D. | 向明矾溶液中滴加少量Ba(OH)22Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(N-M)}{45}$ | B. | $\frac{(M-N)}{45}$ | C. | $\frac{(M-N)}{90}$ | D. | $\frac{(N-M)}{90}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com