
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
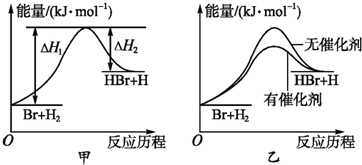
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
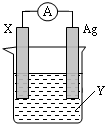 依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子和Y原子最外层都只有一个电子 | |
| B. | X原子2p能级上有三个电子,Y原子的3p能级上有三个电子 | |
| C. | X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2 | |
| D. | X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
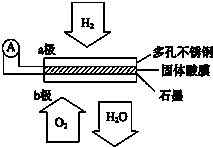 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含非金属元素的化合物不能形成离子键 | |
| B. | 碱金属元素是同周期中金属性最强的元素 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 卤族元素的阴离子还原性越强,其最高价氧化物水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g OH-中含有的电子数为10 NA | |
| B. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 44克14C16O2含氧原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com