
【题目】氯化亚铜(CuCl)是一种重要的化工原料,常用作催化剂、杀菌剂。化学小组用如图装置(部分夹持装置略去)制备氯化亚铜。
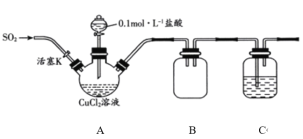
已知:①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3。打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
II.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是________。
(2)步骤I中通入SO2发生反应的离子方程式是________。
(3)步骤II中采用抽滤法过滤的主要目的是________;用95%的乙醇代替蒸馏水洗涤的优点是________。
(4)化学小组同学在实验过程中,将分液漏斗中的0.lmolL-1盐酸换为6molL-1盐酸,通入SO2,最终未得到白色沉淀。
①对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应
小组同学对猜想一的原理进行深入研究,查阅资料知:CuCl+Cl-CuCl2-,据此设计实验:将上述未得到沉淀的溶液_____(填操作),若观察到有白色沉淀析出,证明猜想一正确。
②猜想二:________。
设计验证猜想二是否成立的实验方案________。
【答案】安全瓶或防止发生倒吸 SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+ 快速过滤,防止氯化亚铜被氧化 减小CuCl的损失,同时加快固体的干燥 加水稀释 强酸性条件下,CuCl发生自身氧化还原反应(歧化反应) 取CuCl固体,加入3rnolL-1的H2SO4溶液,若白色沉淀消失,得到蓝色溶液,有红色固体生成,证明猜想二成立,反之,不成立
【解析】
(1)B装置可防止尾气处理时产生倒吸;
(2)SO2与氯化铜溶液反应生成氯化亚铜和硫酸;
(3)步骤II中采用抽滤法可加快过滤的速度,减少有空气接触的时间;已知①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化分析;
(4)①Cl-浓度过大,与CuCl发生反应,减小Cl-浓度的浓度观察是否有沉淀生成;
②根据已知信息②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
(1)SO2属于大气污染物,不能排放到空气中,用NaOH溶液处理尾气时容易引起倒吸,B装置可防止尾气处理时产生倒吸,B装置的作用为安全瓶或防止发生倒吸;
(2)SO2与氯化铜溶液反应生成氯化亚铜和硫酸,离子反应方程式为:SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(3)已知①氯化亚铜是一种白色固体,能溶于氨水,微溶于水,不溶于酒精;在空气中会被迅速氧化,步骤II中采用抽滤法可加快过滤的速度,减少有空气接触的时间,防止氯化亚铜被氧化;氯化亚铜微溶于水,不溶于酒精,且酒精具有挥发性,可快速带走固体表面的水分,则用95%的乙醇代替蒸馏水洗涤的优点是减小CuCl的损失,同时加快固体的干燥;
(4)①Cl-浓度过大,与CuCl发生反应,减小Cl-的浓度观察是否有沉淀生成,则操作为将上述未得到沉淀的溶液加水稀释,若观察到有白色沉淀析出,说明猜想一Cl-浓度过大影响氯化亚铜的生成是正确的;
②根据已知信息②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应,则猜想二为强酸性条件下,CuCl发生自身氧化还原反应(歧化反应),验证猜想的方法为:取CuCl固体,加入3rnolL-1的H2SO4溶液,若白色沉淀消失,得到蓝色溶液,有红色固体生成,证明猜想二成立,反之,不成立。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
2 NH3(g) ΔH=-92.4 kJ·mol-1。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
A. Q1=2Q2=92.4B. 92.4=Q1<2Q2
C. 92.4>Ql>2Q2D. Q1=2Q2<92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国采用的Cu2O/TiO2–NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:
(1)钛(Ti)的基态原子M能层中能量不同的电子有_____________种。
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、![]() 分子中O-H键的极性最强的是_____________。
分子中O-H键的极性最强的是_____________。
②C、N、O三种元素的电负性由大到小的顺序是_____________。
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为_____________mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是_____________。
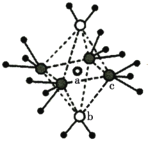
(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为_____________gcm-3 (用含r和NA数学表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
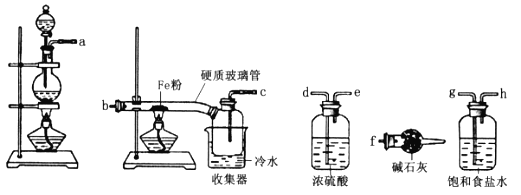
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
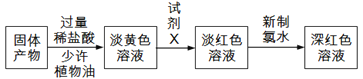
试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
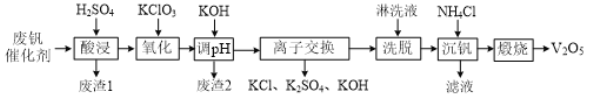
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
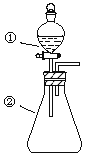
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 新制氯水 | 淀粉碘化钾溶液 | 溶液变蓝色 |
D | 浓盐酸 | MnO2 | 产生黄绿色气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下用![]() 分别滴定
分别滴定![]() 的盐酸和醋酸的曲线如图所示,下列说法正确的是
的盐酸和醋酸的曲线如图所示,下列说法正确的是

A.Ⅰ表示的是滴定盐酸的曲线
B.![]() 时,两份溶液中:
时,两份溶液中:![]()
C.![]() 时,两份溶液中:
时,两份溶液中:![]()
D.![]() 时,醋酸溶液中:
时,醋酸溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡莫氟G是一种抗肿瘤药,卡莫氟具有抑制病毒复制的效果.可能用于治疗感染新型冠状病毒的患者。G的一种合成路线如图所示:

已知:
①AF分子碳链中均不含环状和支链结构。
②H-N=C=O+NH3→![]()
回答下列问题:
(1)A中官能团的名称为___________。
(2)写出B和银氨溶液反应的化学方程式___________。
(3)C→D的反应类型为___________。
(4)F与5—FU反应生成卡莫氟G,5一FU的结构简式为___________,G的分子式为__________________________,
(5)F(C6H13N=C=O)的一种同系物H结构简式为C3H7N=C=O,H的同分异构体中含结构![]() ,但是不含环状结构的共有___________种(不包括立体异构),写出一种核磁共振氢谱为五组峰的同分异构体结构简式___________。
,但是不含环状结构的共有___________种(不包括立体异构),写出一种核磁共振氢谱为五组峰的同分异构体结构简式___________。
(6)DMF(N.N—二甲基甲酰胺)结构简式为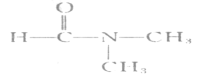 ,是一种重要的化工原料及溶剂。已知R-OH+NH3→RNH2+H2O;R—COOR’+NH3→RCONH2+R’OH。写出以CH3OH为原料制备DMF的合成路线(无机试剂任选)。____________
,是一种重要的化工原料及溶剂。已知R-OH+NH3→RNH2+H2O;R—COOR’+NH3→RCONH2+R’OH。写出以CH3OH为原料制备DMF的合成路线(无机试剂任选)。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com