
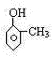
 、
、 、;遇FeCl3溶液不显紫色,则不含酚羟基,故侧链为-CH2OH或-OCH3,其结构简式为:
、;遇FeCl3溶液不显紫色,则不含酚羟基,故侧链为-CH2OH或-OCH3,其结构简式为: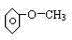 ,
,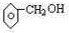 ;
; ;
;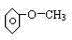 ;
;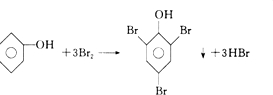 ;
; ,
, ;
;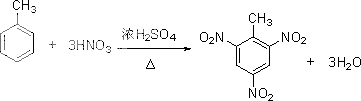 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C、N、O、F |
| B、Na、Be、B、C |
| C、P、S、Cl、Ar |
| D、Na、Mg、Al、Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是表示物质质量的单位 |
| B、摩尔是国际单位制的七个基本物理量之一 |
| C、摩尔既是物质的量的单位,又是粒子的数量单位 |
| D、用摩尔表示物质的量时,要用化学式指明粒子种类,而不用该粒子的中文名称 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com