
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| ||
| 2min |
| 0.0122 |
| 0.01×0.01 |
| 0.006mol/L |
| 0.016mol/L |


科目:高中化学 来源: 题型:
| ||
| 放电 |
| A、上述反应为可逆反应 |
| B、放电时,电池的正极反应为CoO2+Li++e-=LiCoO2 |
| C、锂离子电池可以用水溶液来做电解质溶液 |
| D、锂离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
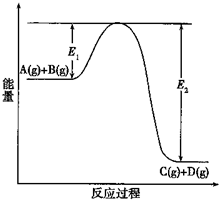 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
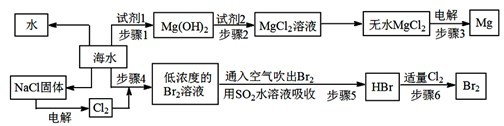
查看答案和解析>>
科目:高中化学 来源: 题型:
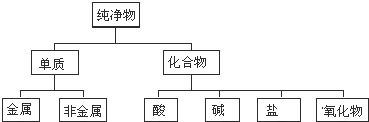
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中加酸有利于NH+4的增多 |
| B、H2、Br2、HBr平衡混合气体加压后颜色变深 |
| C、增大压强有利于二氧化硫生成三氧化硫的反应 |
| D、升温不利于合成氨的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com