
| 19.6g |
| 98g/mol |
| 19.6g |
| 98g/mol |


科目:高中化学 来源: 题型:
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
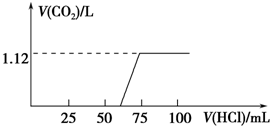 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
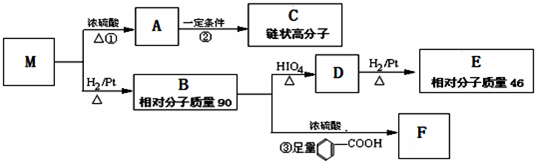

查看答案和解析>>
科目:高中化学 来源: 题型:
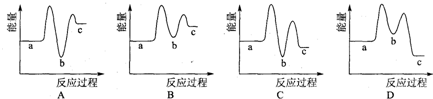
| 物质 n/mol T/℃ |
活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C、N、O、F |
| B、Na、Be、B、C |
| C、P、S、Cl、Ar |
| D、Na、Mg、Al、Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com