
【题目】能说明![]() 元素原子的得电子能力强于
元素原子的得电子能力强于![]() 元素原子的事实是( )
元素原子的事实是( )
A.![]() 元素位于
元素位于![]() 元素的上一个周期
元素的上一个周期
B.![]() 元素的含氧酸的酸性强于
元素的含氧酸的酸性强于![]() 元素的含氧酸
元素的含氧酸
C.分别加热![]() 、
、![]() 的简单氢化物
的简单氢化物![]() 、
、![]() 至500℃,只有
至500℃,只有![]() 发生分解
发生分解
D.![]() 元素与
元素与![]() 元素位于同一主族,在相同温度下二者的单质与铜反应分别生成
元素位于同一主族,在相同温度下二者的单质与铜反应分别生成![]() 和
和![]()
科目:高中化学 来源: 题型:
【题目】(1)用50 mL 0.50 mol·L-1的盐酸与50mL 0.55 mol·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,测定反应过程中所放出的热量并计算每生成1 mol液态水时放出的热量。
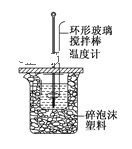
完成下列问题:
①烧杯间填满碎泡沫塑料的作用是__________。
②用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的生成1 mol液态水时放出热量的数值会__________。
(2)现有反应PCl5(g)PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
①该温度下该反应的平衡常数K为__________
②PCl5的平衡转化率为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加![]() 溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是______。
溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是______。
(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为![]() 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为![]() 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
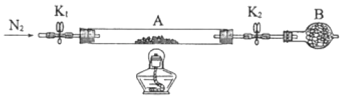
①仪器B的名称是________________。
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d.→e.关闭![]() 和
和![]() →f.称量A。d的操作为________________。
→f.称量A。d的操作为________________。
③重复②的操作步骤,直至A恒重,记为![]() ,根据实验记录,计算绿矾化学式中结晶水数目
,根据实验记录,计算绿矾化学式中结晶水数目![]() ________________(列式表示)。若实验时将a、b的操作次序颠倒,则使x________(填“偏大”“偏小”或“无影响”)。
________________(列式表示)。若实验时将a、b的操作次序颠倒,则使x________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
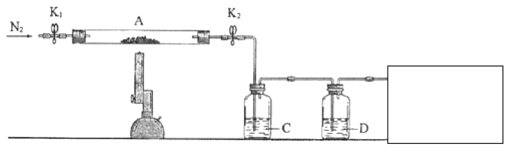
已知:装置C用于检验和吸收分解得到的气体产物之一![]() .
.
①C/D中的溶液依次为________(填标号)。
a、品红 b.![]() c.
c.![]() d.
d.![]() e.浓
e.浓![]()
C、D中有气泡冒出,并可观察到的现象分别为________、________。
②写出硫酸亚铁高温分解反应的化学方程式:________________________。
③在方框中画出尾气吸收装置并注明所用试剂。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图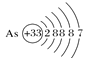 B.BF4—的结构式
B.BF4—的结构式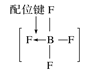
C.HF分子间的氢键 D.丙氨酸的手性异构
D.丙氨酸的手性异构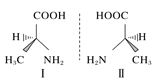
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,R与Y处于同一主族,Z是短周期中金属性最强的金属元素, W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水。下列说法正确的是
A.元素Y、Z、W离子具有相同的电子层结构,其半径依次增大
B.元素X与元素Y能形成两种化学键类型完全相同的化合物
C.元素Y、R分别与元素X形成的化合物的热稳定性: XmY>XmR
D.元素X、Z形成化合物的电子式可以表示成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
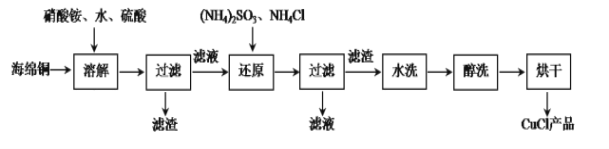
(1)过滤用到的玻璃仪器有烧杯、玻璃棒、________。
(2)还原过程中发生的主要反应的离子方程式:__________,若将(NH4)2SO3换成铁粉也可得到CuCl,写出离子方程式___________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。真空干燥、密封包装的原因是:______________________________。
(4)随着PH值减小[Cu2(OH)4-nCln]中Cu% ________。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是_____。
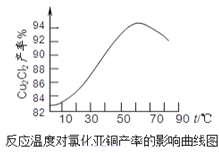
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g) ![]() Y(g),T1、T2温度下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),T1、T2温度下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
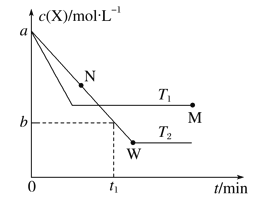
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2温度下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C. M点的正反应速率v正大于N点的逆反应速率v逆
D. M点时再加入一定量Y,平衡后X体积分数与原平衡相比增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
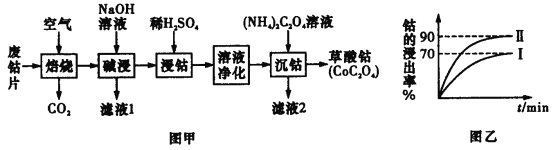
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________(任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。

试解释为何草酸铵溶液沉钴前要减钙镁:______________________________。
(4)滤液2的主要成分为____________________(以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com