
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加![]() 溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是______。
溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是______。
(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为![]() 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为![]() 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
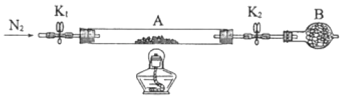
①仪器B的名称是________________。
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d.→e.关闭![]() 和
和![]() →f.称量A。d的操作为________________。
→f.称量A。d的操作为________________。
③重复②的操作步骤,直至A恒重,记为![]() ,根据实验记录,计算绿矾化学式中结晶水数目
,根据实验记录,计算绿矾化学式中结晶水数目![]() ________________(列式表示)。若实验时将a、b的操作次序颠倒,则使x________(填“偏大”“偏小”或“无影响”)。
________________(列式表示)。若实验时将a、b的操作次序颠倒,则使x________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
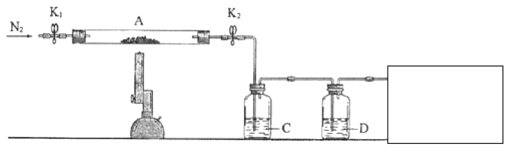
已知:装置C用于检验和吸收分解得到的气体产物之一![]() .
.
①C/D中的溶液依次为________(填标号)。
a、品红 b.![]() c.
c.![]() d.
d.![]() e.浓
e.浓![]()
C、D中有气泡冒出,并可观察到的现象分别为________、________。
②写出硫酸亚铁高温分解反应的化学方程式:________________________。
③在方框中画出尾气吸收装置并注明所用试剂。_________
【答案】溶液变为红色 球型干燥管 冷却至室温 ![]() 小 c、a 有白色沉淀生成 溶液褪色 2FeSO4
小 c、a 有白色沉淀生成 溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑ 
【解析】
(1)含Fe3+的溶液遇KSCN溶液变血红色;Fe2+遇氧气易氧化为Fe3+;
(2)①根据仪器的结构可判断仪器名称;
②实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,冷却至室温再称量固体质量的变化;
③直至A恒重,记为m3g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1)。m(H2O)=(m2-m3),以此计算n(H2O)、n(FeSO4),结晶水的数目等于![]() ;若实验时按a、d次序操作,会导致硫酸亚铁被氧化;
;若实验时按a、d次序操作,会导致硫酸亚铁被氧化;
(3)①硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,D为品红,可用于检验SO2;
②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,结合原子守恒和电子守恒书写化学方程式;
③含有SO2的尾气用NaOH溶液吸收,可防止污染环境。
(1)在试管中加入少量绿矾样品,加水溶解,滴加![]() 溶液,溶液颜色无明显变化,说明溶液中没有Fe3+,可知绿矾样品未变质;再向试管中通入空气,因溶液中Fe2+遇氧气易氧化为Fe3+,则可观察到产生的现象是溶液变为红色;
溶液,溶液颜色无明显变化,说明溶液中没有Fe3+,可知绿矾样品未变质;再向试管中通入空气,因溶液中Fe2+遇氧气易氧化为Fe3+,则可观察到产生的现象是溶液变为红色;
(2)①由仪器的结构和性能可知B为球形干燥管;
②实验时,为避免亚铁被氧化,应先通入氮气,排出生成的水,冷却后注意关闭开关,冷却至室温再称量固体质量的变化,则d的操作为冷却至室温;
③直至A恒重,记为m3g,应为FeSO4和装置的质量,则m(FeSO4)=(m3-m1),m(H2O)=(m2-m3),则n(H2O)=![]() 、n(FeSO4)=
、n(FeSO4)=![]() ,结晶水的数目等于
,结晶水的数目等于![]() ;若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小;
;若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小;
(3)①实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色;
②硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,方程式为2FeSO4![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
③含有SO2的尾气用NaOH溶液吸收,可防止污染环境,具体装置图为 。
。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。请回答下列问题:
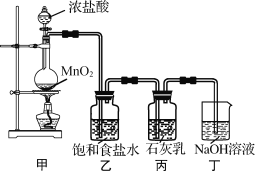
(1)①甲装置用于制备氯气,乙装置的作用是_________。
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是__。(填字母)
A 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B 若产物为NaClO、NaCl,则吸收后的溶液中n(NaClO)=n(NaCl)
C 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
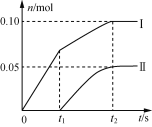
①图中曲线II表示____(填物质的化学式)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为____mol;
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸乙酯具有菠萝香味,可用作食品添加剂。工业上可以用乙烯、丙烯等为原料合成制得。

(1)由CH2=CH2生成有机物A(分子式为C2H6O)的反应类型是____。
(2)丙烯酸乙酯(CH2=CH-COOCH2CH3)中含氧官能团的名称_______。
(3)有机物B的结构简式为______;根据乙烯和乙酸的结构及性质进行类比,关于有机物B的说法正确的是____。
a 有机物B与CH3COOH含有的官能团完全相同
b 可以与NaHCO3溶液反应放出CO2气体
c 在一定条件下可以发生酯化、加成、氧化反应
(4)有机物A、B反应生成丙烯酸乙酯的反应在实验室中可在如图装置中进行。
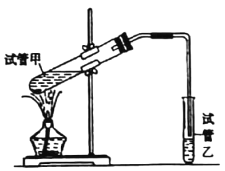
①该反应的化学方程式是___________
②试管乙中试剂的名称是_________,若要将制得的产物分离出来,采用的实验操作是______(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的原子结构如下表:
元素符号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:________,元素Y的最简单氢化物的化学式为_________。
(2)Z元素原子的质量数为_______。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是____________。已知25℃、101 kPa时,1 mol甲烷完全燃烧生成CO2和液态水时放出896 kJ热量,则甲烷的热值为___kJ·g-1。
(2)一定温度下,在偏铝酸亚铜(CuAlO2)的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式__________,其优点是_____(请写出一条)。
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO2(g)![]() N2(g) + CO2(g) + 2H2O(g)。
N2(g) + CO2(g) + 2H2O(g)。
①下列措施能够加快化学反应速率的是______。
a. 使用催化剂 b. 降低温度 c. 及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是_____。
a. 混合气体的质量不再变化
b. c(NO2) = 2c(N2)
c. 单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
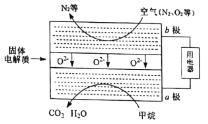
①b极电极反应式为_________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
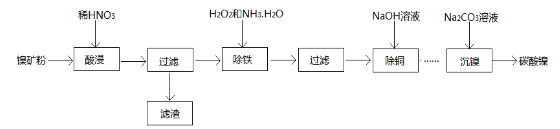
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文献记载所涉及的化学知识叙述错误的是
A. 明代《天工开物》之《燔石·青矾》卷中“取入缸中浸三个小时,漉入釜中煎炼”,运用了过滤的化学操作。
B. “┄欲去杂还纯,再入水煎炼┄倾入盆中,经宿结成白雪”采用了重结晶的方法。
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应。
D. “水银乃至阴之毒物,因火煅丹砂而出,加以硫黄升而为银朱”该过程应用了升华的物理方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明![]() 元素原子的得电子能力强于
元素原子的得电子能力强于![]() 元素原子的事实是( )
元素原子的事实是( )
A.![]() 元素位于
元素位于![]() 元素的上一个周期
元素的上一个周期
B.![]() 元素的含氧酸的酸性强于
元素的含氧酸的酸性强于![]() 元素的含氧酸
元素的含氧酸
C.分别加热![]() 、
、![]() 的简单氢化物
的简单氢化物![]() 、
、![]() 至500℃,只有
至500℃,只有![]() 发生分解
发生分解
D.![]() 元素与
元素与![]() 元素位于同一主族,在相同温度下二者的单质与铜反应分别生成
元素位于同一主族,在相同温度下二者的单质与铜反应分别生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.制取环氧乙烷:CH2=CH2+Cl2+Ca(OH)2→![]() +CaCl2+H2O,原子利用率为53.8%
+CaCl2+H2O,原子利用率为53.8%
B.煤在气化过程中脱硫可以减少污染
C.食品添加剂加入到食品中目的是防腐、保鲜等
D.锂电池应用广泛的主要原因是比能量高、可储存时间长
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com